At lære enzymerne bag cellekommunikation og tumorvækst at kende
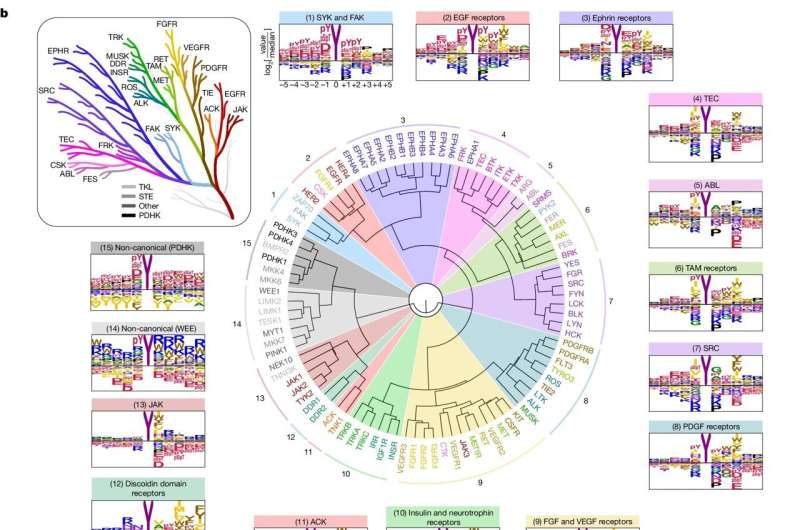
I den menneskelige krop udbreder molekyler kendt som kinaser signaler inden for og mellem celler og videresender signaler, der tillader celler at reagere på ændringer i miljøet. Men der er hundredvis af forskellige kinaser i kroppen, og det er udfordrende at identificere deres individuelle og kollektive funktioner.
I en ny undersøgelse udviklede Yale-farmakolog Benjamin Turk og hans kolleger værktøjer, der kan hjælpe forskere med at skærpe ind på rollerne af individuelle kinaser og begynde at afdække et mere komplet billede af deres kollektive bidrag til biologisk funktion.
Og fordi dysfunktionelle kinaser ofte er impliceret i kræft, kan en mere raffineret forståelse af deres funktion give bedre behandlinger i fremtiden, siger de.
Resultaterne blev offentliggjort i Nature .
Kinaser er enzymer, der letter en proces kaldet phosphorylering. I tilfælde, der involverer proteiner, rekrutterer en proteinkinase et stykke af et molekyle kaldet en fosfatgruppe (et molekylært fragment bestående af et fosforatom og fire oxygenatomer) og hjælper med at binde det til et specifikt område af et protein kendt som et fosforyleringssted. Dette kan ændre proteinets funktion på en række måder, f.eks. ændre dets aktivitet eller hvor det bevæger sig.
Der er to typer proteinkinaser afhængigt af de proteiner, de phosphorylerer:serin/threoninkinaser, som Turk fokuserede på i en tidligere undersøgelse, og tyrosinkinaser, emnet for den nye undersøgelse.
"Især tyrosinkinaser er virkelig vigtige for celle-til-celle og organ-til-organ kommunikation," sagde Turk, lektor i farmakologi ved Yale School of Medicine. "Den største klasse af tyrosinkinaser er forbundet med vækstfaktorer. At forstå, hvordan tyrosinkinaser signalerer, er nøglen til at forstå, hvordan celler kommunikerer med hinanden, hvor den kommunikation ofte er et signal om at vokse eller dele sig."
Alle typer tyrosinkinaser - hvoraf der er 78 hos mennesker - har tendens til at oversende vækstsignaler, når de bliver hyperaktiverede, hvilket er en nøglebegivenhed i tumorvækst, siger Turk.
"Denne form for undersøgelse hjælper os med at forstå organiseringen af tyrosinkinasesignalering, hvilket giver os indsigt i, hvordan kinaser sender vækstsignaler, og hvordan blokerende kinaser kan føre til en terapeutisk reaktion," sagde han.
Til undersøgelsen så forskerne først på, hvordan kinaser genkender deres mål. Proteiner er opbygget af aminosyrer, hvoraf der er 20; kinaser genkender korte strenge af aminosyrer, der omgiver det sted, de phosphorylerer.
Konkret fordelte forskerne hver af de 78 tyrosinkinaser i individuelle brønde på laboratorieplader, blandede dem med et stort antal forskellige aminosyrestrenge og så derefter på, hvilke strenge kinaserne foretrak at fosforylere. De sammenlignede derefter kinasernes foretrukne strenge med proteiner i den menneskelige krop.
"Og vi lærte et par ting ved at gøre dette," sagde Turk.
For det første kunne de til en vis grad begynde at matche kinaser med deres mål i kroppen, hvilket giver forskerne information om den specifikke rolle af en bestemt kinase.
Måske endnu vigtigere, deres resultater tillod dem at afdække nogle af de bredere regler for tyrosinkinaseaktivitet. Det var, som om de begyndte at se ledningerne til et hus snarere end blot hvor de enkelte stikkontakter var, sagde Turk.
En af disse regler har at gøre med, hvordan tyrosinkinaser rekrutterer yderligere kinaser til at udbrede en signaleringskaskade. En anden involverer, hvordan aminosyrer, der omgiver et phosphoryleringssted, ikke kun dikterer, hvor phosphorylering vil ske, men også den hastighed, hvormed den finder sted.
Og, hvad der er vigtigt for behandlingsudvikling, giver de værktøjer, der er udviklet i denne undersøgelse, forskerne mulighed for at udlede, hvilke kinaser der kan være aktive i en celle eller væv på et bestemt tidspunkt, og hvordan forstyrrende dem kan påvirke deres funktion.
"Vi kan bruge lægemidler til at hæmme individuelle kinaser, og når vi gør det, kan vi se aktiviteten af den kinase falde," sagde Turk. "Og tyrosinkinasehæmmere er en af de vigtigste målrettede kræftbehandlinger. Men kræftceller kan tilpasse sig den slags terapi og blive resistente over for det, hvilket får patienter til at få tilbagefald."
Med deres værktøjer kan forskerne observere, hvordan blokering af en kinase med en inhibitor nogle gange fører til, at andre kinaser bliver overaktiverede, hvilket kan forklare, hvordan kræftceller tilpasser sig og fortsætter med at vokse. Og det kan hjælpe forskere med at udvikle mere effektive terapier, sagde Turk.
Fremadrettet sigter Turk mod at bruge reglerne, der er afdækket i dette arbejde, til at begynde at pirre biologiske nøgleprocesser fra hinanden og se nærmere på, hvordan forskellige celler reagerer på forskellige kinasehæmmere.
Men der er en anden vigtig del af dette arbejde for ham.
Tyrosinkinaser er nyere, evolutionært set, end andre kinaser, der opstår med flercellede organismer. Da Turk og hans kolleger sammenlignede menneskelige tyrosinkinaser med dem i nematoder - en type orm, som den menneskelige gren af det evolutionære træ adskilte sig fra for millioner af år siden - specificiteten af begge grupper af kinaser, eller hvor særlige de er med hensyn til deres mål, var yderst ens.
"Det siger, at denne specificitet - og at forstå, hvordan den opstår - virkelig betyder noget," sagde Turk. "Det er bevaret gennem millioner af års evolution, og naturen ville ikke have bevaret det i så fine detaljer uden grund."
Flere oplysninger: Lewis Cantley, Den iboende substratspecificitet af det humane tyrosinkinom, Nature (2024). DOI:10.1038/s41586-024-07407-y. www.nature.com/articles/s41586-024-07407-y
Journaloplysninger: Natur
Leveret af Yale University
 Varme artikler
Varme artikler
-
 Forskere har skabt en effektiv løsning til opsamling af spildt petroleumResultatet af de overfladeaktive stoffers virkning. Kredit:Ravan Rahimov Kemikere fra RUDN University har syntetiseret nye overfladeaktive stoffer og undersøgt deres egenskaber. De opnåede forbind
Forskere har skabt en effektiv løsning til opsamling af spildt petroleumResultatet af de overfladeaktive stoffers virkning. Kredit:Ravan Rahimov Kemikere fra RUDN University har syntetiseret nye overfladeaktive stoffer og undersøgt deres egenskaber. De opnåede forbind -
 Smugler effektivt medicin ind i cellerFluorescerende bløde perler, der passerer gennem de indsnævrede kanaler i en biochip. Kredit:MPZPM, Salvatore Girardo En ny, patenteret metode kaldet Progressive Mechanoporation gør det muligt mek
Smugler effektivt medicin ind i cellerFluorescerende bløde perler, der passerer gennem de indsnævrede kanaler i en biochip. Kredit:MPZPM, Salvatore Girardo En ny, patenteret metode kaldet Progressive Mechanoporation gør det muligt mek -
 Hvordan stressede tumorceller undslipper celledød:Ny mekanisme opdagetEn model af et cystein persulfid molekyle. Kredit:Nature Chemical Biology (2022). DOI:10.1038/s41589-022-01145-w En celle dør af ferroptose, når frie radikaler kommer ud af kontrol og ødelægger den
Hvordan stressede tumorceller undslipper celledød:Ny mekanisme opdagetEn model af et cystein persulfid molekyle. Kredit:Nature Chemical Biology (2022). DOI:10.1038/s41589-022-01145-w En celle dør af ferroptose, når frie radikaler kommer ud af kontrol og ødelægger den -
 Ny hybridelektrolyt til højtydende Li-ion-batterierEt fotografi (venstre), henholdsvis et scanningselektronmikroskopbillede (i midten) og en skematisk illustration af sammensat elektrolytstruktur (til højre). Kredit:Grewal og Yabu. Li-ion-batterier
Ny hybridelektrolyt til højtydende Li-ion-batterierEt fotografi (venstre), henholdsvis et scanningselektronmikroskopbillede (i midten) og en skematisk illustration af sammensat elektrolytstruktur (til højre). Kredit:Grewal og Yabu. Li-ion-batterier
- Dyrkning af alger mere bæredygtigt til produktion af biobrændstof
- NASA lyser beacon på månen med test af autonomt navigationssystem
- Et ultraviolet instrument til ESAs Jupiter-mission
- Forskning viser, at tykkere belægning er mere omkostningseffektiv hen ad vejen
- Nyt solidt smøremiddel har vist sig at reducere friktion og slid på ståloverflader
- Californien kræver 100 procent nul-emission busflåde


