Nyt kemisk værktøj til at forstå membranomdannelse i cellen
I en undersøgelse offentliggjort i Proceedings of the National Academy of Sciences , Umeå forskere beskriver et naturligt produkt-lignende molekyle, Tantalosin, der hæmmer interaktion mellem to proteiner i komplekser, der omformer membraner inde i cellen.
Resultaterne fører til en dybere forståelse af, hvordan membranombygning fungerer i menneskelige celler og fremtidig udvikling af nye lægemidler.
"Vores undersøgelse er et godt eksempel på at bruge små molekyler som værdifulde kemiske redskaber til at forstå komplekse biologiske mekanismer. Jeg er glad for at koordinere et fantastisk samarbejde med kolleger i Umeå, Stockholm og Tyskland," siger Yaowen Wu, professor ved Institut for Kemi ved Umeå Universitet.
Membraner af celler er lavet af lipider og proteiner, og de tjener barrierefunktioner for celler og intracellulære organeller. Membraner af celler er meget dynamiske mosaik-væske strukturer, der gennemgår konstant omformning. Det endosomale sorteringskompleks, der kræves til transport (ESCRT), har til opgave at ombygge membraner inde i cellen. ESCRT-maskineriet samles på det sted i cellen, hvor membraner skal deformeres, og danner derefter spiralformede proteinpolymerer, der kan trække sig sammen og klemme cellemembraner af.
Tidligere har professor Yaowen Wu og hans gruppe i samarbejde med professor Herbert Waldmanns laboratorium ved Max Planck Institute Dortmund i Tyskland identificeret et kemisk molekyle, Tantalosin, der inducerer en fænotype som autofagi - en selvspisende proces i cellen.
Tantalosin er et syntetisk molekyle inspireret af alkaloider fra medicinplanten Cinchona. Holdet observerede et meget interessant fænomen i cellen behandlet med Tantalosin og undersøgte yderligere den molekylære mekanisme, hvordan Tantalosin virker i cellen. I samarbejde med den kemiske proteomik-kernefacilitet på SciLifeLab i Karolinska Institutet undersøgte holdet potentielle cellulære mål for Tantalosin.
"Til vores overraskelse fandt vi ud af, at ingen af de autofagi-relaterede proteiner var på listen over potentielle mål. Imidlertid blev IST1-protein i ESCRT-komplekser identificeret og valideret som det cellulære mål for Tantalosin. Vi var spændte på at arbejde på at dechifrere dette uventede sammenhæng mellem ESCRT-komplekser og autofagi," siger førsteforfatter Anastasia Knyazeva, der netop har afsluttet sin doktorgrad ved Institut for Kemi ved Umeå Universitet.
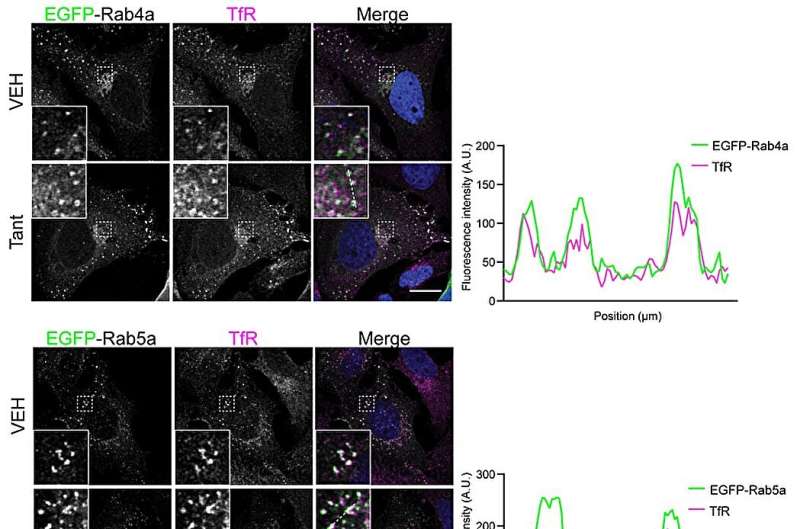
Forskerne karakteriserede mekanismen ved hjælp af en række biokemiske og cellebiologiske metoder. Da de undersøgte protein-protein-interaktion i opløsning, fandt de ud af, at Tantalosin fuldstændig stopper interaktionen mellem IST1 og dets bindingspartner CHMP1B.
"Vi kiggede derefter nærmere på disse to proteiner ved hjælp af et transmissionselektronmikroskop i samarbejde med Kasturika Shankar, en ph.d.-studerende fra Lars-Anders Carlsons laboratorium ved Umeå Universitet. Spændende nok forstyrrer Tantalosin dannelsen af ordnede IST1-CHMP1B filamenter ," forklarer Shuang Li, avisens første forfatter og postdoc ved Institut for Kemi ved Umeå Universitet.
Desuden kiggede forskerne ind i cellen og fandt ud af, at tantalosin hurtigt forstyrrer genanvendelsen af celleoverfladereceptorer tilbage til celleoverfladen. Denne egenskab kan være potentielt gavnlig til behandling af visse typer kræft, der drives af celleoverfladereceptorer.
I denne undersøgelse fandt forskerne ud af, at LC3-protein, som normalt er et kendetegn for autofagi, er forbundet med de endosomale membraner under Tantalosin-behandling. Interessant nok blev den kanoniske autofagiske nedbrydning ikke observeret. I stedet fandt de ud af, at processen følger en ikke-kanonisk autofagi-vej.
"Vi mener, at Tantalosin kan være et unikt molekyle, der letter forståelsen af nye funktioner af ikke-kanonisk konjugering af LC3 til endosomale membraner. Vi håber, at yderligere undersøgelser vil afsløre rollen af LC3-membrankonjugation og dets associerede proteiner i membrandeformationsprocesser," siger Knyazeva .
Flere oplysninger: Anastasia Knyazeva et al., En kemisk hæmmer af IST1-CHMP1B-interaktion hæmmer endosomal genanvendelse og inducerer ikke-kanonisk LC3-lipidering, Proceedings of the National Academy of Sciences (2024). DOI:10.1073/pnas.2317680121
Journaloplysninger: Proceedings of the National Academy of Sciences
Leveret af Umea University
 Varme artikler
Varme artikler
-
 2-D molekylære krystaller, der modulerer elektroniske egenskaber af organiske halvledereSkema af den nederste port, topkontakt OFETer baseret på 1D/2D sammensatte enkeltkrystaller og skematisk diagram af I-V kurver før og efter doping. Kredit:Science China Press Organiske felteffektt
2-D molekylære krystaller, der modulerer elektroniske egenskaber af organiske halvledereSkema af den nederste port, topkontakt OFETer baseret på 1D/2D sammensatte enkeltkrystaller og skematisk diagram af I-V kurver før og efter doping. Kredit:Science China Press Organiske felteffektt -
 Plasmabehandling reducerer migration af blødgørere fra blodposerEksperimentel samling til DBD (dielektrisk barriereudladning) behandling af PVC-film. Kredit:Fraunhofer IST Medicinske produkter som blodposer og slanger er ofte fremstillet af blød PVC, en plasti
Plasmabehandling reducerer migration af blødgørere fra blodposerEksperimentel samling til DBD (dielektrisk barriereudladning) behandling af PVC-film. Kredit:Fraunhofer IST Medicinske produkter som blodposer og slanger er ofte fremstillet af blød PVC, en plasti -
 Dengue -infektion korrelerer med dynamik snarere end morfologierKredit:National University of Singapore NUS -biofysikere har opdaget nye konformationsændringer og strukturelle dynamikker af denguevirus under deres overførsel til menneskelige værter. Dengue-in
Dengue -infektion korrelerer med dynamik snarere end morfologierKredit:National University of Singapore NUS -biofysikere har opdaget nye konformationsændringer og strukturelle dynamikker af denguevirus under deres overførsel til menneskelige værter. Dengue-in -
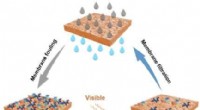 Forskere udvikler N-dopede selvrensende membraner, der bruger bestråling af synligt lysSkematisk diagram af N-TiO 2 og TiO 2 overtrukket membranforberedelse og mekanisme for synligt lysaktiveret fotokatalyse til begroningsbegrænsning. Kredit:ZHANG Huiru Forskere fra Institute of
Forskere udvikler N-dopede selvrensende membraner, der bruger bestråling af synligt lysSkematisk diagram af N-TiO 2 og TiO 2 overtrukket membranforberedelse og mekanisme for synligt lysaktiveret fotokatalyse til begroningsbegrænsning. Kredit:ZHANG Huiru Forskere fra Institute of
- Facebook får sine messaging -apps til at være venner
- Hvordan selvkørende biler kunne skrumpe parkeringspladser
- Forskere lokker proteiner til at danne syntetiske strukturer med en metode, der efterligner naturen
- Den stablede farvesensor
- Panikkøb, ignorerer sikkerhedsforanstaltninger:Krisens socialpsykologi
- Magnetisme genereret i 2D organisk materiale ved stjernelignende arrangement af molekyler


