Mikrotyngdekraftsdyrkede krystaller afslører ny indsigt i proteinstrukturer
Biokemikere har længe arbejdet omkring en blind plet, når det kommer til proteiner. De ved, at brint udgør næsten halvdelen af atomerne i proteiner, men hvordan de bidrager til proteinfunktionen i disse komplekse strukturer har været mindre klart. Hydrogenatomer er så små, at traditionelle strukturbiologiske teknikker ikke kan afsløre deres positioner.
"Så du mangler halvdelen af informationen," sagde Dr. Victoria Drago, en post-doc forskningsassistent ved Oak Ridge National Laboratory (ORNL) i Tennessee og nyligt alumna fra University of Toledo.
Ikke at have en fuldstændig redegørelse for placeringen af et proteins brintatomer er en gåde med implikationer ud over laboratoriet, herunder i strukturbaseret lægemiddeldesign.
Drago begyndte at udforske en teknik til at lokalisere ellers undvigende hydrogener, der involverede dyrkning af proteinkrystaller i mikrotyngdekraft som kandidatstuderende sammen med Dr. Timothy Mueser, en professor i UToledo Department of Chemistry and Biochemistry.
Analysen af disse krystaller – et kemiudtryk, der i dette tilfælde refererer til det præcise arrangement af de konstituerende atomer og molekyler – er grundlaget for en nylig offentliggjort forskningsartikel i tidsskriftet Cell Reports Physical Science .
"Vi brugte neutrondiffraktion," sagde Drago, der er hovedforfatter af papiret, og som dimitterede med en doktorgrad i kemi i 2022. "Vi var i stand til at udføre eksperimentet og opnå høj opløsning ved at udnytte mikrotyngdekraften til at dyrke krystaller af høj kvalitet af enzymet."
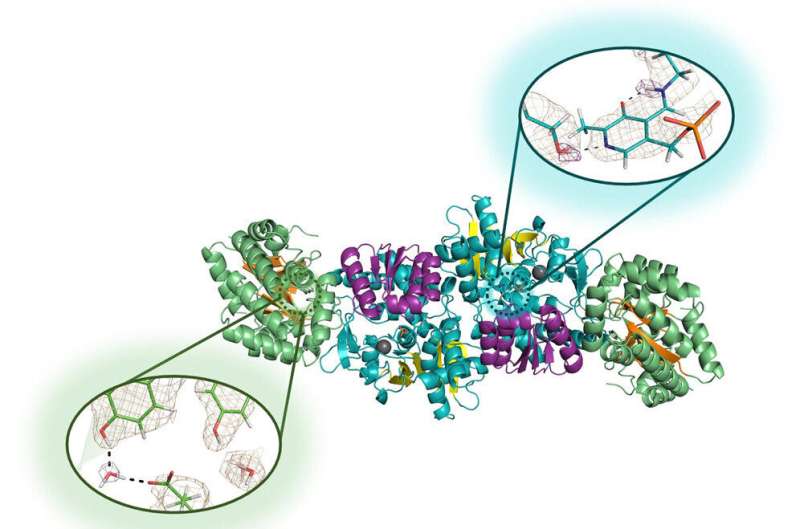
Neutrondiffraktion er en højteknologisk proces, der gør det muligt for forskere at kortlægge de præcise placeringer af et molekyles hvert enkelt atom. Det virker til at identificere placeringen af små brintatomer, som med andre atomer, men signalet er ekstremt svagt i traditionelle strukturbiologiske teknikker. Derfor vendte de sig mod mikrogravitation, som muliggør vækst af større og mere perfekt strukturerede krystaller.

Drago, Mueser og deres samarbejdspartnere ved ORNL og Institut Laue-Langevin, et førende atomforskningsanlæg i Grenoble, Frankrig, sendte løsninger af enzymet tryptofansyntase op til en måneds tur på den internationale rumstation i 2018, og igen for en seks måneders rejse i 2019 til 2020. Den anden tur gav adskillige meget store, perfekte krystaller - mange omkring en kubikmillimeter, fem gange større end de forskere voksede i laboratorier - som rejste mere end 50 millioner miles og overlevede et 9G-splashdown i Stillehavet.
Neutrondiffraktion viste sig at være vellykket på disse krystaller, hvilket gjorde det muligt for forskerne for første gang at afsløre det aktive steds hydrogener af enzymet, de valgte at studere.
Tryptophansyntase er videnskabeligt værdifuld som repræsentant for en stor og meget alsidig familie af enzymer, der bruger vitamin B6 til funktion. Fordi mennesker ikke producerer tryptofansyntase, er det også attraktivt for lægemiddeldesignere, der er interesseret i at udnytte den kemiske struktur af proteiner i deres udvikling af nye forbindelser til at bekæmpe patogene mikroorganismer såsom Salmonella enterica, Staphylococcus aureus og Mycobacterium tuberculosis.
Flere oplysninger: Victoria N. Drago et al., Neutrondiffraktion fra en krystal dyrket i mikrotyngdekraft afslører de aktive stedshydrogener i den indre aldiminform af tryptophansyntase, Cell Reports Physical Science (2024). DOI:10.1016/j.xcrp.2024.101827
Journaloplysninger: Cell Rapporter Fysisk Videnskab
Leveret af University of Toledo
 Varme artikler
Varme artikler
-
 Effektiv, stabilt termoelektrisk modul baseret på højtydende væskelignende materialerKredit:CC0 Public Domain Baseret på højtydende væskelignende materialer, videnskabsmænd fra Shanghai Institute of Ceramics ved det kinesiske videnskabsakademi og Northwestern University i USA frem
Effektiv, stabilt termoelektrisk modul baseret på højtydende væskelignende materialerKredit:CC0 Public Domain Baseret på højtydende væskelignende materialer, videnskabsmænd fra Shanghai Institute of Ceramics ved det kinesiske videnskabsakademi og Northwestern University i USA frem -
 Forskere udnytter gelpolymerelektrolyt til højtydende magnesiumbatterierDet skematiske diagram over strukturen og anvendelsesområderne for PTB@GF-GPE Kredit:DU Aobing Elektroniske produkter, elektriske køretøjer og storstilet energilagring, der er tæt knyttet til menn
Forskere udnytter gelpolymerelektrolyt til højtydende magnesiumbatterierDet skematiske diagram over strukturen og anvendelsesområderne for PTB@GF-GPE Kredit:DU Aobing Elektroniske produkter, elektriske køretøjer og storstilet energilagring, der er tæt knyttet til menn -
 Fremskyndelse af brintskabelse med en cokatalysator af ikke-ædelmetal under synligt lysBrintudvikling over Mo2 C@MAPbI3 . Kredit:Shanghai Key Lab of Chemical Assessment and Sustainability, School of Chemical Science and Engineering, Tongji University Halidperovskitter har vist sig at
Fremskyndelse af brintskabelse med en cokatalysator af ikke-ædelmetal under synligt lysBrintudvikling over Mo2 C@MAPbI3 . Kredit:Shanghai Key Lab of Chemical Assessment and Sustainability, School of Chemical Science and Engineering, Tongji University Halidperovskitter har vist sig at -
 Gennemfyldt med huller:Gør fleksibel tyndfilmselektronik mere holdbarGentagen bøjning forårsager uoprettelig skade på fleksible ledere i form af mikroskopiske revner. At udvikle omkostningseffektive måder at løse dette problem på er en forudsætning, før fleksible elekt
Gennemfyldt med huller:Gør fleksibel tyndfilmselektronik mere holdbarGentagen bøjning forårsager uoprettelig skade på fleksible ledere i form af mikroskopiske revner. At udvikle omkostningseffektive måder at løse dette problem på er en forudsætning, før fleksible elekt
- Forskellen mellem Vejr og Erosion
- Forbedring af jordoverflademodeller for at visualisere vegetationsgradienter i bakket terræn
- At spore kilden til ulovligt sand – kan det lade sig gøre?
- Crowdsourced spil har til formål at finde løsninger på aflatoksin
- Eksperter beregner fremtidigt istab og bidrag til havniveau i Grønland og Antarktis
- Politisk polarisering:Ofte ikke så slemt, som vi tror


