Ny metode afslører hemmeligheder bag proteininteraktioner med potentiale for lægemiddelopdagelse
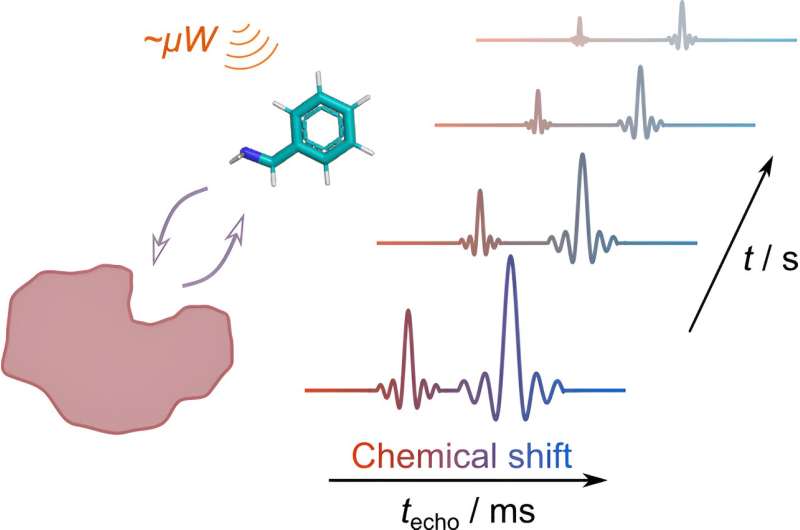
Forskere fra University of Oulu (Finland) og Texas A&M University (USA) har udviklet en ny metode til at studere, hvordan proteiner interagerer med små ligandmolekyler, hvilket f.eks. baner vejen for hurtigere og mere effektiv opdagelse af lægemidler.
Denne interaktion, kendt som protein-ligand-interaktion, er afgørende for mange biologiske processer, men at studere den har traditionelt været langsom og ufølsom. Den nye metode, beskrevet i Journal of the American Chemical Society , kombinerer to avancerede teknikker for at overvinde disse begrænsninger.
En metode har potentiale til at revolutionere vores forståelse af proteininteraktioner som en del af cellers kontinuerlige kommunikation. Disse interaktioner og de forstyrrelser, der kan forekomme, kan spille en væsentlig rolle for eksempel i udviklingen af autoimmune sygdomme og neurodegenerative sygdomme som Alzheimers sygdom. For eksempel kan dysfunktionelle interaktioner også føre til aggressiv cellevækst og cancer.
"Den metode, vi har udviklet, kan markant fremskynde udviklingen af nye lægemidler og hjælpe os med at forstå mekanismerne bag mange sygdomme meget bedre," siger Dr. Otto Mankinen fra NMR Research Unit, Uleåborg Universitet.
Hurtig og detaljeret analyse
Den første teknik, Dissolution Dynamic Nuclear Polarization (d-DNP) hyperpolarisering, fungerer som en signalforstærker, der signifikant forbedrer signalet fra ligandmolekylet, der undersøges. Især når man studerer lave mængder af stoffer og kerner med lav overflod, såsom kulstof-13, er hyperpolarisering et afgørende værktøj til at gøre signalet observerbart.
Den anden teknik, Ultrahurtig NMR, tillader brugen af hyperpolarisering til måling af multidimensionelle NMR-data. Konventionelt målte multidimensionelle NMR-målinger kræver flere gentagelser for at indsamle fuldstændige data.
I den ultrahurtige tilgang er en af dimensionerne kodet langs prøvevolumenet i lag med en metode kaldet rumlig kodning. Efter indkodningen læses informationen med principperne for magnetisk resonansbilleddannelse (MRI). I dette tilfælde blev NMR-spektret rumligt kodet, og derefter blev dæmpningen af signalet i tid overvåget for flere spektrale toppe.
Ved at kombinere disse teknikker kan forskere nu få detaljeret information om protein-ligand-binding i et enkelt eksperiment for flere ligandsignaler. Konventionel tilgang er begrænset til et enkelt signal pr. måling. Dette åbner døre for mere effektiv lægemiddelopdagelse ved at give videnskabsfolk mulighed for bedre at forstå, hvordan potentielle lægemiddelmolekyler interagerer med deres proteinmål.
Flere oplysninger: Chang Qi et al., Measuring Protein-Ligand Binding by Hyperpolarized Ultrafast NMR, Journal of the American Chemical Society (2024). DOI:10.1021/jacs.3c14359
Journaloplysninger: Tidsskrift for American Chemical Society
Leveret af University of Oulu
Sidste artikelEn ny metode til opbevaring og behandling af hydrogenchlorid
Næste artikelKlikkemi:Forskerhold skaber 150 nye forbindelser
 Varme artikler
Varme artikler
-
 Dette computerprogram gør pharma patenter lufttættehans grafiske abstrakt illustrerer, hvordan ved at identificere og holde styr på vigtige afbrydelser, der er afgørende for patentbeskyttede synteser, et retrosyntetisk computerprogram kan autonomt des
Dette computerprogram gør pharma patenter lufttættehans grafiske abstrakt illustrerer, hvordan ved at identificere og holde styr på vigtige afbrydelser, der er afgørende for patentbeskyttede synteser, et retrosyntetisk computerprogram kan autonomt des -
 Ingeniører designer ny fast polymer elektrolyt, baner vejen for sikrere, mindre batterier og brænd…Forskernes nye struktur samles selv til hårnåleformer, resulterer i syreforede kanaler, der muliggør effektiv transport af protoner hen over elektrolytten. Kredit:Nature Materials Brændselsceller
Ingeniører designer ny fast polymer elektrolyt, baner vejen for sikrere, mindre batterier og brænd…Forskernes nye struktur samles selv til hårnåleformer, resulterer i syreforede kanaler, der muliggør effektiv transport af protoner hen over elektrolytten. Kredit:Nature Materials Brændselsceller -
 Væske-lignende bevægelse i krystaller kan forklare deres lovende adfærd i solcellerIllustration af perovskittens krystalstruktur. Molekylerne roterer omkring deres hængsler i to dimensioner, som kunne forklare materialets fotovoltaiske evner. Kredit:Jill Hemman, Oak Ridge National L
Væske-lignende bevægelse i krystaller kan forklare deres lovende adfærd i solcellerIllustration af perovskittens krystalstruktur. Molekylerne roterer omkring deres hængsler i to dimensioner, som kunne forklare materialets fotovoltaiske evner. Kredit:Jill Hemman, Oak Ridge National L -
 Udvikling af nye processer til at undersøge nogle af de sjældneste og mest giftige grundstoffer på…En ny forbindelse af curium (et radioaktivt, sjældent og kostbart grundstof) fotograferet ved LLNL under krystallografiske eksperimenter. Holdet fra LLNL og OSU brugte de såkaldte polyoxometalate liga
Udvikling af nye processer til at undersøge nogle af de sjældneste og mest giftige grundstoffer på…En ny forbindelse af curium (et radioaktivt, sjældent og kostbart grundstof) fotograferet ved LLNL under krystallografiske eksperimenter. Holdet fra LLNL og OSU brugte de såkaldte polyoxometalate liga
- ESA flyver nyttelast på træsatellit
- På kurs mod sundere, mere bæredygtig jord
- Forskere bruger polystyren til at gøre næste generations solpaneler endnu billigere
- Flere forsinkelser for Boeings nye rumkapsel til astronauter
- Rwandas æteriske olier giver store overskud fra lille jord
- Nogle arter kan bedre tolerere klimaændringer end forventet


