Klikkemi:Forskerhold skaber 150 nye forbindelser
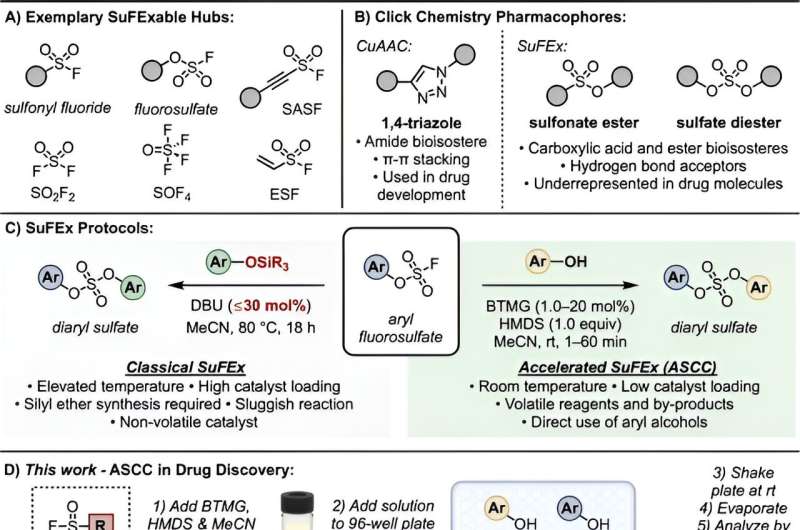
Cold Spring Harbor Laboratory (CSHL) kemikere har skabt en ny samling af molekylære forbindelser og er begyndt at teste dem som potentielle ledere i søgningen efter nye lægemidler. Blandt disse molekyler fandt de flere, der viser lovende udvikling som antibiotika og kræftbehandlinger. Lyder det som et eureka-øjeblik? Nå, sådan en. Men det er mere et tilfælde af hård kemi gjort simpelt.
De nye forbindelser blev syntetiseret ved hjælp af en effektiv ny måde at forbinde molekyler sammen på, udviklet i laboratoriet af CSHL Professor John Moses. Moses kalder sin innovative proces Accelerated SuFEx Click Chemistry (ASCC). Det er et af de seneste fremskridt inden for det nobelvindende felt for klikkemi, pioneret af Moses' mentor, K. Barry Sharpless.
Klikkemi sætter hurtigt molekyler sammen for at skabe komplekse nye strukturer. Dette gør det muligt for lægemiddeludviklere at samle et stort antal forbindelser til yderligere udforskning. Med Accelerated SuFEx kan klikkemi generere flere forbindelser i færre trin og med højere udbytter.
"Hvis du kan lave molekyler, kan du teste dem," forklarer Moses. "Og med denne teknologi kan du gøre dem hurtige."
Moses og hans team brugte ASCC til at skabe mere end 150 individuelle nye forbindelser, herunder derivater af komplekse naturlige molekyler. Tidligere kunne det have taget måneder at generere og oprense et sådant udvalg af molekyler. Moses og hans team havde dem klar inden for få dage. De testede derefter disse nye molekyler på kræftceller og lægemiddelresistente bakteriestammer.
I et sæt eksperimenter syntetiserede Joshua Homer, en forskningsforsker i Moses' laboratorium, en række molekyler, der lignede en anti-cancerforbindelse kaldet combretastatin A4. Homer fandt ud af, at to af de nye molekyler kunne dræbe kræftceller, der typisk modstår standard kemoterapi. Disse molekyler kan en dag føre til en løsning til svære at behandle typer af bryst- og bugspytkirtelkræft.
Forskerne skabte også molekyler, der lignede et antibiotikum kaldet dapson. De så, at nogle af disse molekyler var effektive mod dapson-resistente bakterier. Homer siger, at ASCC kunne hjælpe kemikere med at omstrukturere andre komplekse antibiotika for at overvinde patogeners hærdede forsvar.
Når vi ser fremad, vil Moses og hans team fortsætte med at bruge ASCC til at udforske nye horisonter for lægemiddelopdagelse og finjustere deres kundeemner til potentielle lægemiddelkandidater. I mellemtiden håber de, at andre forskere også vil introducere Accelerated SuFEx-teknologi til deres egne lægemiddelopdagelsesplatforme.
Opsummerer fordelene ved ASCC, siger Moses:"Det er bare en måde at finde funktion på. Du kan altid forbedre tingene og optimere dem. Men lad os nå dertil så hurtigt som muligt. Forhåbentlig kan vi fremskynde hele processen."
Forskningen er publiceret i tidsskriftet Chemical Science .
Flere oplysninger: Joshua A. Homer et al., Modulær syntese af funktionelle biblioteker ved accelereret SuFEx-klikkemi, Chemical Science (2024). DOI:10.1039/D3SC05729A
Journaloplysninger: Kemisk videnskab
Leveret af Cold Spring Harbor Laboratory
 Varme artikler
Varme artikler
-
 Undersøgelse baner vejen for oprettelse af tænd- og slukknapper til kemiske reaktionerVed at arbejde under ekstremt kontrollerede forhold, Eric Hudson og hans kolleger kunne observere egenskaber ved atomer og molekyler, der tidligere har været skjult for øje. Kredit:Stuart Wolpert/UCLA
Undersøgelse baner vejen for oprettelse af tænd- og slukknapper til kemiske reaktionerVed at arbejde under ekstremt kontrollerede forhold, Eric Hudson og hans kolleger kunne observere egenskaber ved atomer og molekyler, der tidligere har været skjult for øje. Kredit:Stuart Wolpert/UCLA -
 Ny teknik muliggør real-time mikroskopi ved høj varme og belastningEt kig inde i in situ scanning elektronmikroskopi varme- og indlæsningsenhed. Kredit:North Carolina State University Forskere har demonstreret en teknik, der giver dem mulighed for at spore mikros
Ny teknik muliggør real-time mikroskopi ved høj varme og belastningEt kig inde i in situ scanning elektronmikroskopi varme- og indlæsningsenhed. Kredit:North Carolina State University Forskere har demonstreret en teknik, der giver dem mulighed for at spore mikros -
 Forskere finder værdi i usædvanlig type plantematerialeKredit:CC0 Public Domain Et ideelt bioraffinaderi ville forvandle vedvarende afgrøder til en række forskellige brændstoffer og produkter med lidt affald. En væsentlig udfordring i at realisere den
Forskere finder værdi i usædvanlig type plantematerialeKredit:CC0 Public Domain Et ideelt bioraffinaderi ville forvandle vedvarende afgrøder til en række forskellige brændstoffer og produkter med lidt affald. En væsentlig udfordring i at realisere den -
 Nye aktive ingredienser fra værktøjskassenSkematisk diagram af værktøjskassesystemet af NRPS-enzymer til produktion af nye aktive ingredienser. Fragmenter fra naturlige systemer (grøn, magenta, blå) samles igen i en ny rækkefølge (midten) og
Nye aktive ingredienser fra værktøjskassenSkematisk diagram af værktøjskassesystemet af NRPS-enzymer til produktion af nye aktive ingredienser. Fragmenter fra naturlige systemer (grøn, magenta, blå) samles igen i en ny rækkefølge (midten) og
- Hæmmet af scientisme? Forsker undersøger historien om amerikansk samfundsvidenskab
- Forskere konstruerer verdens første aerogeler lavet af skrotdæk
- 10 tips fra glade mennesker
- Middelhavet står over for hårdere hedebølger, tørke, brande:FN udkast til rapport
- Forskere finder, at tweeting i byer er lavere end forventet
- Historisk kort afslører, hvordan muslingefarmen bringer skaldyrsrev tilbage til havbunden


