Forskere identificerer klasse af bindingsmolekyler, der kan bruges til målrettet proteinnedbrydning
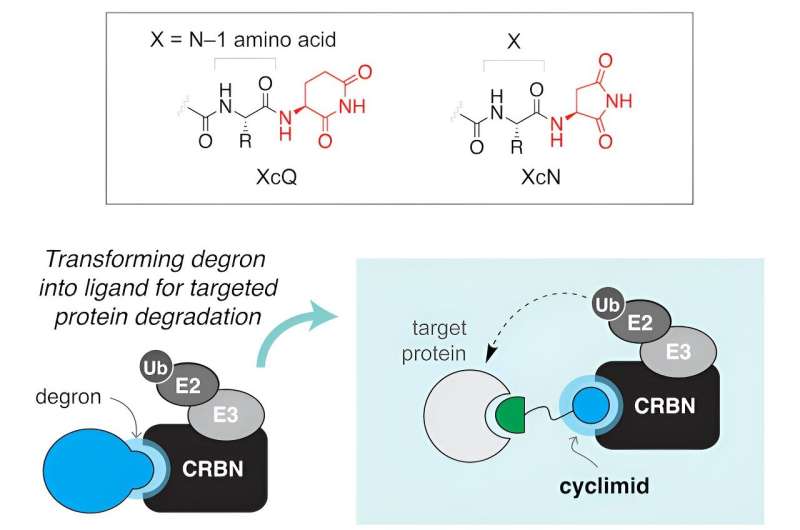
I kampen mod kræft og andre sygdomme udvikler forskere molekylære våben, der kan bruges til at stoppe ukontrollerbar cellevækst.
Et team af forskere fra Harvard og Massachusetts General Hospital har fundet ud af, at "cyklimider", en klasse af bindende molekyler kendt som ligander, tilbyder en lovende og effektiv tilgang til at fjerne sygdomsfremkaldende eller funktionssvigtende proteiner. Deres særlige egenskaber gør det muligt for forskere at angribe vildfarne proteiner ved deres molekylære rødder.
"I over et år havde vi beskæftiget os med spørgsmålet om, hvad er de naturlige ligander, der genkendes af cereblon, et protein, der er afgørende for målrettet nedbrydning," sagde senior medforfatter Christina Woo, Morris Kahn lektor i kemi og kemisk biologi. "Denne undersøgelse karakteriserer disse ligander omfattende for at give ny indsigt i cereblons biologi og hvordan man kaprer det."
I de senere år har forskere konstrueret små molekyler til specifikt at målrette proteiner forbundet med sygdom. Disse molekyler har to roller:de låser sig fast på målproteinet, der skal fjernes, og deres "sprænghoved" går i indgreb med en del af det cellulære oprydningssystem, der ofte binder til et protein kaldet cereblon. Tilsammen danner disse specialiserede molekyler, hvad videnskabsmænd kalder et ternært kompleks. Når først dette kompleks er etableret, bliver målproteinet effektivt markeret til bortskaffelse af cellens proteasom, der fungerer som et cellulært genbrugssystem.
Succesen med denne proces – fjernelse af specifikke proteiner – afhænger af det molekylære sprænghoveds design og effektivitet, hvilket gør dem til afgørende elementer i udviklingen af terapier til forskellige sygdomme, herunder kræft.

I forskernes papir offentliggjort i Cell Chemical Biology , fandt de ud af, at mindre strukturelle ændringer på cereblonliganden dramatisk kan ændre biologiske aktiviteter i celler. I samarbejde med Mazitschek Lab, som har lavet omfattende forskning i identifikation af sygdomsrelevante molekylære mål, introducerede forskerne en systematisk biokemisk tilgang til kvantificering af ternær kompleksdannelse. Denne metode gør det muligt for forskere at forudsige den cellulære nedbrydningsaktivitet af cyclimider mere effektivt, hvilket strømliner udviklingsprocessen.
"Vi har givet samfundet et kraftfuldt og overkommeligt mikroskop med vores metode," sagde Ralph Mazitschek, co-senior forfatter. "Vi har etableret en omfattende, pålidelig, robust og følsom profileringsplatform, der er anvendelig til stort set alle disse små molekyle nedbrydningsmidler og molekylære lim nedbrydere."
"Dette var et samarbejde i ordets sandeste betydning," sagde Connor Payne, postdoc i Mazitscheks laboratorium. "Vi havde forskellige ekspertise og forskellige teknologier, som vi var ved at udvikle, så synergien mellem dem var virkelig, virkelig smuk at se blive til virkelighed."
Fremadrettet er Woo og Mazitschek optimistiske om, at cyclimider og deres screeningsplatforme vil blive inkorporeret i proteinnedbrydningsstrategier, som kan være nyttige til udvikling af lægemidler og behandling af kræftsygdomme.
"Jeg tror, at vores forskning i sidste ende vil lette profileringen af mange flere molekyler mod ønskede mål og nå frem til mere selektive og effektive molekyler hurtigere," sagde Woo. "Der er mange forskellige retninger, det kan tage os."
Flere oplysninger: Saki Ichikawa et al., The cyclimids:Degron-inspirerede cereblon-bindere til målrettet proteinnedbrydning, Cell Chemical Biology (2024). DOI:10.1016/j.chembiol.2024.01.003
Journaloplysninger: Cellekemisk biologi
Leveret af Harvard University
Denne historie er offentliggjort med tilladelse fra Harvard Gazette, Harvard Universitys officielle avis. Besøg Harvard.edu for yderligere universitetsnyheder.
 Varme artikler
Varme artikler
-
 Ny teststrimmel bevarer spor, som blodprøver ofte savnerFilterets layout og et nærbillede af overfladedetaljen. Koagulerede blodlegemer er angivet med rødt. Plasma, der fylder kanalen, er angivet med gult. Og den blå sektion indikerer den tomme rest af kan
Ny teststrimmel bevarer spor, som blodprøver ofte savnerFilterets layout og et nærbillede af overfladedetaljen. Koagulerede blodlegemer er angivet med rødt. Plasma, der fylder kanalen, er angivet med gult. Og den blå sektion indikerer den tomme rest af kan -
 3-D-print af grønnere bygninger ved hjælp af lokal jordForskere har udviklet en metode til at 3D-printe strukturer ved hjælp af lokal jord. Kredit:Aayushi Bajpayee Byggebranchen står i øjeblikket over for to store udfordringer:efterspørgslen efter bær
3-D-print af grønnere bygninger ved hjælp af lokal jordForskere har udviklet en metode til at 3D-printe strukturer ved hjælp af lokal jord. Kredit:Aayushi Bajpayee Byggebranchen står i øjeblikket over for to store udfordringer:efterspørgslen efter bær -
 Kemikere udvikler hydrogelstrenge ved hjælp af forbindelse fundet i havdyrRice University kemikere brugte klæbeevnen af en forbindelse fundet i muslinger og forskydningskraft til at hjælpe en nanoskala, multidomæne peptid, set øverst, samles selv til et fiberbundt, der ka
Kemikere udvikler hydrogelstrenge ved hjælp af forbindelse fundet i havdyrRice University kemikere brugte klæbeevnen af en forbindelse fundet i muslinger og forskydningskraft til at hjælpe en nanoskala, multidomæne peptid, set øverst, samles selv til et fiberbundt, der ka -
 Visualisering af varmeflow i bambus kan hjælpe med at designe mere energieffektive og brandsikre by…Kredit:Pixabay Modificerede naturlige materialer vil være en væsentlig komponent i en bæredygtig fremtid, men først er der behov for en detaljeret forståelse af deres egenskaber. Måden varme strøm
Visualisering af varmeflow i bambus kan hjælpe med at designe mere energieffektive og brandsikre by…Kredit:Pixabay Modificerede naturlige materialer vil være en væsentlig komponent i en bæredygtig fremtid, men først er der behov for en detaljeret forståelse af deres egenskaber. Måden varme strøm
- Udtalelse:Abortfængselsdom viser, at loven er fokuseret på fostre - hvorfor det er farligt for kvi…
- Ny rapport hævder brudt system svigter migrantarbejdere, der lider af løntyveri
- Blockbuster antitrust-retssag over AT&T, Time Warner-fusionen begynder
- Hvorfor er plastikposer så dårlige for miljøet?
- Et vigtigt skridt mod vækst af menneskelige nyrer i laboratoriet
- Michigan vintre, som generationer har kendt dem, kan være ved at være slut


