Ny beregningsstrategi øger lægemiddeldesignernes evne til at målrette proteiner inde i membranen
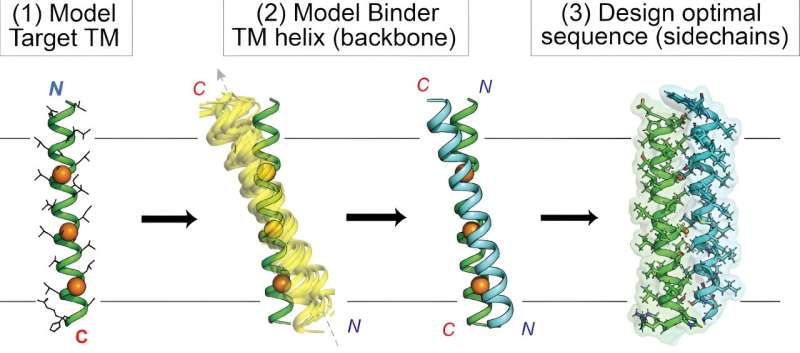
At ramme mål indlejret i cellemembranen har længe været vanskeligt for lægemiddeludviklere på grund af membranens udfordrende biokemiske egenskaber. Nu har Scripps Research-kemikere demonstreret nye specialdesignede proteiner, der effektivt kan nå disse "intramembrane"-mål.
I deres undersøgelse, "De Novo Transmembrane Proteins Designed to Binding and Inhibit a Cytokine Receptor" offentliggjort i Nature Chemical Biology , brugte forskerne en unik computerbaseret tilgang til at designe nye proteiner rettet mod den membranspændende region af erythropoietin (EPO) receptoren, som styrer produktionen af røde blodlegemer og kan gå galt i kræftformer. Ud over disse nye EPO-målrettede molekyler gav undersøgelsen en generel beregningsproces eller "workflow" til at strømline det fleksible brugerdefinerede design af proteiner rettet mod intramembrane mål.
Forskerne bruger nu deres tilgang til at udvikle potentielle nye intramembran-målrettede behandlinger på tværs af en lang række sygdomme.
"Dette arbejde åbner op for mange nye muligheder for modulering af mål inden for cellemembranen, herunder til terapeutiske anvendelser og forståelse af signalmekanismer på tværs af cellebiologi," siger studiets co-korresponderende forfatter Marco Mravic, Ph.D., en assisterende professor i Institut for Integrativ Strukturel og Beregningsbiologi ved Scripps Research.
Undersøgelsens andre co-korresponderende forfattere var Daniel DiMaio, MD, Ph.D., fra Yale School of Medicine; og William DeGrado, Ph.D., fra University of California, San Francisco School of Pharmacy, hvor Mravic tidligere var ph.d. studerende.
"Et hovedmål med syntetisk biologi er at designe proteiner med biologisk aktivitet - her rapporterer vi design og test af et lille protein, der specifikt forstyrrer aktiviteten af en meget større proteinreceptor involveret i blodcellevækst og -differentiering," siger DiMaio, der er professor i genetik og molekylær biofysik og biokemi og vicedirektør for Yale Cancer Center.
"Vi opnåede dette ved at målrette det segment af receptoren, der krydser cellemembranen. Fordi mange celleproteiner indeholder strukturelt bevarede membranspændende segmenter, kan denne generelle tilgang være anvendelig til mange andre proteinmål og giver et nyt værktøj til at modulere adfærden af celler."
At ramme intramembran-mål har længe været et vigtigt mål inden for biomedicin, da mange proteiner i celler - især receptorproteiner - har funktionelt vigtige domæner inde i membranen. Sådanne proteiner har fremtrædende roller inden for næsten alle områder af sundhed og sygdom.
Alligevel er intramembrane mål ikke almindelige mål. Cellemembraner er generelt lavet af to lag af tæt anbragte, fedtrelaterede "lipid"-molekyler, som er vandafvisende og har andre unikke og komplekse egenskaber. Dette gør intramembranrummet til et meget sværere mål for lægemiddeldesignere sammenlignet med de vandige zoner af celleoverflader eller interiør.
"Der har været meget få vellykkede eksempler på lægemidler, der retter sig mod dette rum inde i membranen," siger Mravic.
Disse få succeser, som inkluderer behandlinger for lavt blodpladelidelse og cystisk fibrose, er kommet fra blinde screeninger af store sammensatte biblioteker eller fra tæt efterligning af proteiner, der vides at interagere med partnerproteiner i cellemembranen.
I modsætning hertil satte Mravic og kolleger sig for at designe helt nye proteiner - små kaldet peptider - for at ramme intramembranproteinmål på nye og forskellige måder. For at gøre det var de nødt til at udvide grænsen for beregningsmetoder ved at kombinere "data mining" af kendte protein-til-protein-interaktioner i membraner med traditionelle fysik-baserede forudsigelser af protein-interaktioner.
I sidste ende designet Mravic og hans kolleger de første proteiner, der binder EPO-receptorens membranspændende del på en ny måde - ikke set i naturen. Holdet viste, at disse proteiner meget specifikt og potent blokerer receptorens funktion i modsætning til tidligere tilgange.
Resultaterne kan være af mest umiddelbar interesse for forskere, der søger nye måder at hæmme EPO-receptoren, som ofte aktiveres unormalt af tumorceller for at opretholde deres vækst og overlevelse. Men for Mravic og hans kolleger repræsenterer undersøgelsen frem for alt et principbevis på en ny og mere fleksibel tilgang til intramembran-målretning.
"Vi har til hensigt at bruge denne tilgang til at målrette membranproteiner på tværs af flere biologiske processer og sygdomsområder, herunder kræftformer, immunforstyrrelser og smerte," siger Mravic.
Han forventer også, at den beregningsmæssige arbejdsgang, han designede til projektet, vil være en generel accelerator for membran-målrettet lægemiddeldesign.
"Før involverede processen dybest set, at to personer i et mørkt rum kiggede på en computerskærm og sagde:'Ja, jeg synes, det her ser bedre ud end det'," siger Mravic. "Nu har vi automatiseret en masse af den molekyledesignproces og beslutningstagning i computeren. Ved at være mere modulopbygget, fleksibelt og strømlinet kan metoden være mere tilgængelig for en bredere vifte af videnskabsmænd."
Mravic og hans kolleger har offentliggjort deres beregningsværktøjer til offentlig brug på Github.
Flere oplysninger: De Novo Transmembrane Proteiner designet til at binde og hæmme en cytokinreceptor, Naturkemisk biologi (2024). DOI:10.1038/s41589-024-01562-z , www.nature.com/articles/s41589-024-01562-z
Leveret af The Scripps Research Institute
Sidste artikelBlød støtte kan lave uventet stabilt glas
Næste artikelNy katalysator accelererer frigivelsen af brint fra ammoniak
 Varme artikler
Varme artikler
-
 Ny bærerdoping i p-type halvledere forbedrer fotovoltaisk enheds ydeevne ved at øge hulkoncentrati…Grafisk abstrakt. Kredit:Tokyo Tech Perovskite-solceller har været genstand for megen forskning som den næste generation af solceller. Der er dog stadig mange udfordringer, der skal overvindes for
Ny bærerdoping i p-type halvledere forbedrer fotovoltaisk enheds ydeevne ved at øge hulkoncentrati…Grafisk abstrakt. Kredit:Tokyo Tech Perovskite-solceller har været genstand for megen forskning som den næste generation af solceller. Der er dog stadig mange udfordringer, der skal overvindes for -
 Selvsamling påkrævet:Neutrons sonde ny polymeradfærd for biomedicinske materialerORNL-instrumentforsker Shuo Qian forbereder Bio-SANS-instrumentet på HFIR til et eksperiment ledet af LSU-professor Donghui Zhang. Zhang bruger neutronspredning til at studere alsidige proteinlignende
Selvsamling påkrævet:Neutrons sonde ny polymeradfærd for biomedicinske materialerORNL-instrumentforsker Shuo Qian forbereder Bio-SANS-instrumentet på HFIR til et eksperiment ledet af LSU-professor Donghui Zhang. Zhang bruger neutronspredning til at studere alsidige proteinlignende -
 Forskere identificerer kemiske årsager til, at batterikapaciteten falmerNår manganioner (grå) fjernes fra et batteris katode (blå), de kan reagere med batteriets elektrolyt nær anoden (guld), indfangning af lithium-ioner (grøn/gul). Kredit:Robert Horn/Argonne National Lab
Forskere identificerer kemiske årsager til, at batterikapaciteten falmerNår manganioner (grå) fjernes fra et batteris katode (blå), de kan reagere med batteriets elektrolyt nær anoden (guld), indfangning af lithium-ioner (grøn/gul). Kredit:Robert Horn/Argonne National Lab -
 Forskere er tæt på kræftbehandlinger ved hjælp af CRISPRKredit:CC0 Public Domain Kemoterapi arbejder ud fra en grundlæggende forudsætning:dræb alle hurtigt voksende celler i et forsøg på at udslette tumorceller. Taktikken, selvom det generelt er effekt
Forskere er tæt på kræftbehandlinger ved hjælp af CRISPRKredit:CC0 Public Domain Kemoterapi arbejder ud fra en grundlæggende forudsætning:dræb alle hurtigt voksende celler i et forsøg på at udslette tumorceller. Taktikken, selvom det generelt er effekt
- Nissan CEO, der er ramt af en krise, vil trække sig, når bestyrelsen mødes
- Er Styrofoam genanvendeligt?
- Tilbagevendende mars-striber:flydende sand, ikke vand?
- Elektronisk affald genbruges under forfærdelige forhold i Indien
- En ud af fire arbejdende plejere overvejer at sige deres job op, viser forskning
- FCC siger nu, at der ikke var nogen cyberangreb i kommentatorperioden for netneutralitet


