Hvordan vand styrer samlingen af kollagen, alle menneskers byggesten
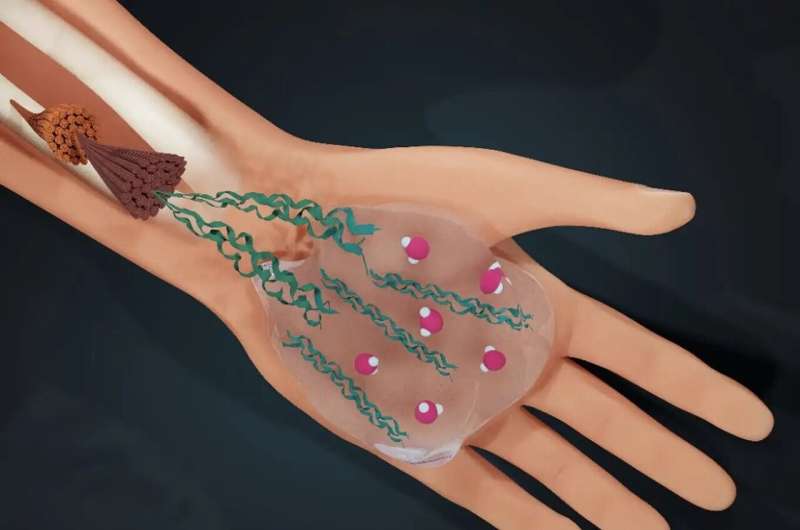
Vand bestemmer livet:mennesker er tre fjerdedele vand. Et internationalt forskerhold ledet af University of Amsterdam (UvA) har nu opdaget, hvordan vand også bestemmer strukturen af det materiale, der holder os sammen:kollagen.
I et papir udgivet i PNAS , belyser forskerne vands rolle i den molekylære selvsamling af kollagen. De viser, at ved at erstatte vand med dets 'tvillingmolekyle' tungt vand (D2 O), kan man 'tune' interaktionen mellem kollagenmolekyler og dermed påvirke processen med selvsamling af kollagen. Resultaterne vil hjælpe til bedre at forstå vævssvigt som følge af arvelige kollagen-relaterede sygdomme, såsom knogleskørhed (osteogenesis imperfecta).
Som hovedforfatter Dr. Giulia Giubertoni fra UvA's Van 't Hoff Institut for Molekylær Videnskab (HIMS) udtrykker det:"Ved at studere disse og andre kollagensygdomme har mange forskere, inklusive mig selv, ... altid gået glip af en vigtig del af puslespil, og muligheden for, at vævssvigt delvist skyldes vand-kollagen-interaktion, blev ikke taget særlig alvorligt. Vi viser nu, at forstyrrelse af vandlaget omkring proteinet, selv meget lidt, har dramatiske effekter på kollagensamlingen."
Giubertoni ønsker at gøre forskere i kollagen-sygdomssamfundet opmærksomme på, at meget subtile ændringer i vand-kollagen-interaktionen kan bidrage til kollagensygdomme. Disse ændringer kan potentielt opstå, for eksempel fra mutationer i kollagenproteinet, som forekommer ved genetiske sygdomme. Forskerne foreslår også, at ændrede interaktioner mellem vand og kollagen er en medvirkende faktor i forskellige aldersrelaterede sygdomme, der involverer vævsdysfunktion.
De ting, vi er lavet af
Kollagen er i høj grad 'det vi er lavet af' - omkring en tredjedel af alt protein i vores krop er kollagen, som sikrer den mekaniske integritet af alt menneskeligt bindevæv.
For eksempel strækker vores hud og arterier sig uden at rives, og vores knogler kan modstå høj stress uden at knække. Kollagen produceres af vores celler som enkelte proteiner, der samles i større strukturer kaldet fibriller. Disse fibriller samles yderligere i netværk, der danner stilladserne for vores væv.
Da kollagen dannes i det vandige miljø af menneskelige celler, spiller vand en afgørende rolle i dets samling. Samspillet mellem vandmolekyler og proteiner resulterer i kollagen, der er bedst egnet til dets funktion. Men hvad er der egentlig bag vandets kollagenoptimerende rolle? Hvordan gør vand det? Og vil forståelsen af denne mekanisme give indsigt i forhold, hvor der er noget galt med kollagen, såsom osteogenesis imperfecta? Disse var de centrale spørgsmål i forskningen offentliggjort i PNAS .
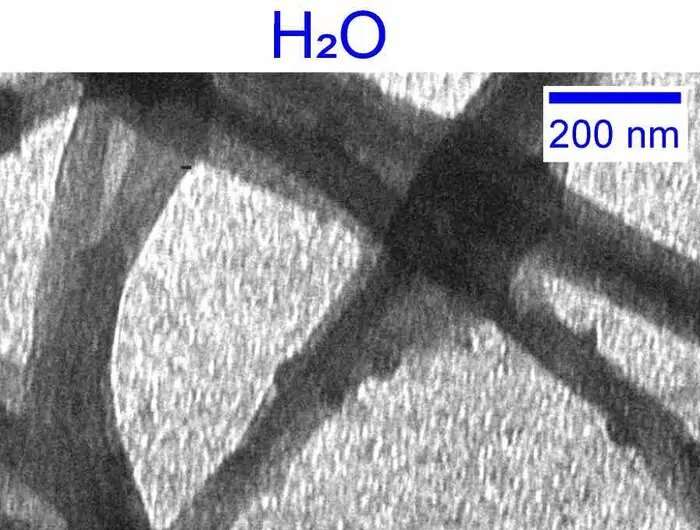
Introduktion af tungt vand
For at undersøge vands rolle i kollagendannelsen besluttede Giubertoni – sammen med sin UvA-kollega Prof. Sander Woutersen og deres samarbejdspartner Prof. Gijsje Koenderink (Delft University of Technology) – at erstatte vand med dets tungere 'tvillingmolekyle' D 2 O. Oprindeligt opdaget af nobelprisvinderen Harold Urey i 1931, i D2 O vandets hydrogenatomer (H) er erstattet med isotopen deuterium (D), der har en tilføjet neutron i sin kerne. D2 O eller 'tungt vand' er således den 'nærmeste erstatning' til almindeligt vand i naturen.
Men i interaktion med proteiner, D2 O er mindre potent end H2 O. Dette skyldes, at bindinger mellem D2 O-molekyler (såkaldte hydrogenbindinger) er stærkere end dem mellem H2 O molekyler. Dette påvirker interaktionen med proteiner såsom kollagen.
Giubertoni, Woutersen og Koenderink var ivrige efter at undersøge, hvilken effekt dette ville have på kollagensamlingen. Sammen med et tværfagligt samarbejdende forskningsnetværk var de i stand til at fastslå, at brugen af tungt vand resulterer i ti gange hurtigere kollagendannelse og i sidste ende et mindre homogent, blødere og mindre stabilt kollagen-fiber-netværk.
En meget effektiv moderator
Forklaringen er, at tungvandets reducerede interaktion med kollagenproteinet gør det nemmere for proteinet at 'ryste' D2 af sig. O molekyler og reorganisere sig selv.
Dette booster dannelsen af kollagen-netværket, men resulterer også i et mere sjusket, mindre optimalt kollagen-netværk. Vand fungerer således som en mediator mellem kollagenmolekyler, hvilket bremser samlingen for at garantere levende vævs funktionelle egenskaber.
Denne opdagelse giver nye perspektiver på, hvordan vand påvirker kollagens egenskaber, hvilket giver mulighed for præcise justeringer i levende vævs mekaniske egenskaber. Det skaber også nye veje til at skabe kollagenbaserede materialer, hvor makroskopiske egenskaber kan kontrolleres og finjusteres af subtile variationer i opløsningsmidlets sammensætning i stedet for at foretage væsentlige ændringer i den kemiske struktur af de molekylære byggesten.
En lignende "undersøgende" tilgang kan også blive brugt i fremtiden til at belyse vands rolle i at drive og styre samlingen af andre proteiner, der er i stand til at samles i større strukturer. Giubertoni vil gå videre med at studere, hvordan defekter i kollagen påvirker dets interaktion med vand, og hvilken rolle dette spiller i svigt af væv i kollagensygdomme.
Flere oplysninger: Giulia Giubertoni et al., Belysning af vands rolle i selvsamling af kollagen ved isotopisk modulering af kollagenhydrering, Proceedings of the National Academy of Sciences (2024). DOI:10.1073/pnas.2313162121
Journaloplysninger: Proceedings of the National Academy of Sciences
Leveret af University of Amsterdam
 Varme artikler
Varme artikler
-
 Forskere opdager unikke multifibrillære fibreElektrospinning af en multifibrillær polyacrylonitrilfiber. Kredit:University of Bayreuth / Rennecke. Stærk og sej, men alligevel så lette som en fjer - materialer med denne enestående kombination
Forskere opdager unikke multifibrillære fibreElektrospinning af en multifibrillær polyacrylonitrilfiber. Kredit:University of Bayreuth / Rennecke. Stærk og sej, men alligevel så lette som en fjer - materialer med denne enestående kombination -
 At forstå, hvordan en katalysator omdanner metan til ethen, kan forhindre flaring af naturgasDeponi brænder flare af. Kredit:Eddie Hagler/Public Domain Det ville være en tredobbelt sejr - for klimaet, råmaterialeressourcer, og den kemiske industri. Med deres arbejde, videnskabsfolk ved Fr
At forstå, hvordan en katalysator omdanner metan til ethen, kan forhindre flaring af naturgasDeponi brænder flare af. Kredit:Eddie Hagler/Public Domain Det ville være en tredobbelt sejr - for klimaet, råmaterialeressourcer, og den kemiske industri. Med deres arbejde, videnskabsfolk ved Fr -
 Forskere udvikler nye, hurtig pipeline for antimikrobielle stofferASU-forskere har for nylig mødt en udfordring med at udvikle en ny klasse af antimikrobielle stoffer, kaldet synbodies, at beskytte befolkningen mod smitsomme trusler - alt sammen inden for en uge. Kr
Forskere udvikler nye, hurtig pipeline for antimikrobielle stofferASU-forskere har for nylig mødt en udfordring med at udvikle en ny klasse af antimikrobielle stoffer, kaldet synbodies, at beskytte befolkningen mod smitsomme trusler - alt sammen inden for en uge. Kr -
 Røntgenlaserundersøgelse identificerer krystallinsk mellemprodukt i vores vej til vejrtrækningAustin Echelmeir (venstre til højre), Alexandra Ros, Petra Fromme og Raimund Fromme alle fra ASUs School of Molecular Sciences og Biodesign Institutes Center for Applied Structural Discovery. Kredit:M
Røntgenlaserundersøgelse identificerer krystallinsk mellemprodukt i vores vej til vejrtrækningAustin Echelmeir (venstre til højre), Alexandra Ros, Petra Fromme og Raimund Fromme alle fra ASUs School of Molecular Sciences og Biodesign Institutes Center for Applied Structural Discovery. Kredit:M
- Maskinlæring reducerer sprogbarrierer i global handel, viser forskning
- Smuk som en påfugl:Ædelstenen til næste generation af smarte sensorer
- ALMA finder livsingrediens omkring spædbarns sollignende stjerner
- Holdet undersøger, hvordan opvarmning påvirker optagelse og frigivelse af kuldioxid i subarktiske …
- Nanopartikler kan begrænse inflammation ved at distrahere immunsystemet
- Rekonstruktion af Notre Dame akustik


