Hvad varme kan fortælle os om batterikemi:Brug af Peltier-effekten til at studere lithium-ion-celler
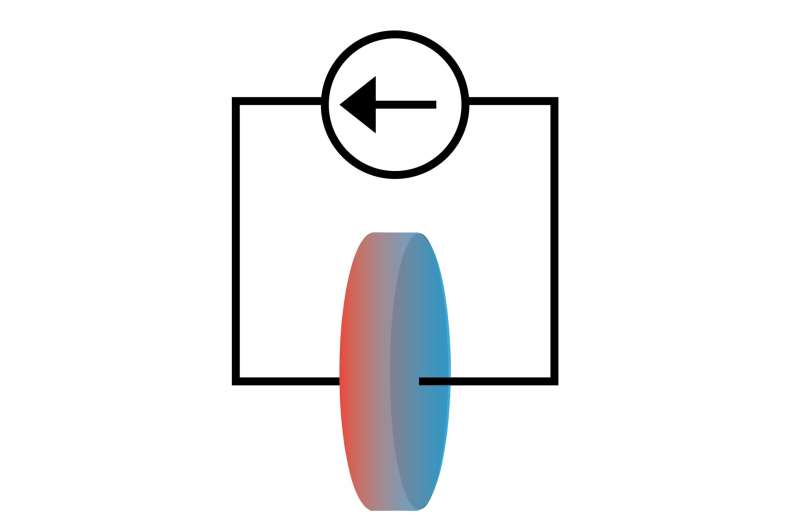
Batterier studeres normalt via elektriske egenskaber som spænding og strøm, men ny forskning tyder på, at observation af, hvordan varme flyder i forbindelse med elektricitet, kan give vigtig indsigt i batterikemi.
Et team af forskere ved University of Illinois Urbana-Champaign har demonstreret, hvordan man studerer de kemiske egenskaber af lithium-ion-battericeller ved at udnytte Peltier-effekten, hvor elektrisk strøm får et system til at trække varme. Rapporteret i tidsskriftet Physical Chemistry Chemical Physics , gav denne teknik dem mulighed for eksperimentelt at måle entropien af lithium-ion-elektrolytten, en termodynamisk funktion, der direkte kunne informere lithium-ion-batteridesignet.
"Vores arbejde handler om at forstå den grundlæggende termodynamik af opløste lithium-ioner, information, som vi håber vil guide udviklingen af bedre elektrolytter til batterier," sagde David Cahill, en U. of I. materialevidenskab og ingeniørprofessor og projektleder. "Måling af den koblede transport af elektrisk ladning og varme i Peltier-effekten giver os mulighed for at udlede entropien, en mængde, der er tæt forbundet med den kemiske struktur af de opløste ioner, og hvordan de interagerer med andre dele af batteriet."
Peltier-effekten er velundersøgt i faststofsystemer, hvor den bruges til køling og køling. Det forbliver dog stort set uudforsket i ioniske systemer som lithiumelektrolyt. Årsagen er, at temperaturforskellene skabt af Peltier-opvarmning og -køling er små sammenlignet med andre effekter.
For at overvinde denne barriere brugte forskerne et målesystem, der var i stand til at løse en hundrede tusindedel af en grad Celsius. Dette gjorde det muligt for forskerne at måle varmen mellem de to ender af cellen og bruge den til at beregne entropien af lithium-ion elektrolytten i cellen.
"Vi måler en makroskopisk egenskab, men den afslører stadig vigtige oplysninger om ionernes mikroskopiske adfærd," sagde Rosy Huang, en kandidatstuderende i Cahills forskningsgruppe og studiets medforfatter. "Målinger af Peltier-effekten og opløsningens entropi er tæt forbundet med solvatiseringsstrukturen. Tidligere stolede batteriforskere på energimålinger, men entropi ville give et vigtigt supplement til den information, der giver et mere komplet billede af systemet."
Forskerne undersøgte, hvordan Peltier-varmestrømmen ændrede sig med koncentrationen af lithiumioner, opløsningsmiddeltype, elektrodemateriale og temperatur. I alle tilfælde observerede de, at varmestrømmen løb modsat ionstrømmen i opløsningen, hvilket antyder, at entropien fra opløsningen af lithiumioner er mindre end entropien af fast lithium.
Evnen til at måle entropien af lithium-ion elektrolytopløsninger kan give vigtig indsigt i ionernes mobilitet, styrende batteriets genopladningscyklus, og hvordan opløsningen interagerer med elektroderne, en vigtig faktor i batteriets levetid.
"Et undervurderet aspekt af batteridesign er, at den flydende elektrolyt ikke er kemisk stabil, når den er i kontakt med elektroderne," sagde Cahill. "Det nedbrydes altid og danner noget, der kaldes en fast-elektrolyt-interfase. For at gøre et batteri stabilt over lange cyklusser, skal du forstå termodynamikken i den interfase, hvilket er, hvad vores metode hjælper med at gøre."
Zhe Cheng er den anden co-lead forfatter af undersøgelsen. Beniamin Zahiri, Patrick Kwon og U. of I. Materials Science &Engineering professor Paul Braun bidrog også til dette arbejde.
Flere oplysninger: Zhe Cheng et al., Ionisk Peltier-effekt i Li-ion-elektrolytter, Physical Chemistry Chemical Physics (2024). DOI:10.1039/D3CP05998G
Journaloplysninger: Fysisk kemi Kemisk Fysik
Leveret af University of Illinois Grainger College of Engineering
 Varme artikler
Varme artikler
-
 Et gennembrud inden for forskning i chiral polymer tyndfilm kunne muliggøre en ny generation af enh…Oprindelsen af de kirotiske effekter udforsket i dette værk. (a) en tegneserie, der skildrer de mekanismer, der understøtter den kirotiske reaktion i ikke-opstillede og justerede tynde film, og (b)
Et gennembrud inden for forskning i chiral polymer tyndfilm kunne muliggøre en ny generation af enh…Oprindelsen af de kirotiske effekter udforsket i dette værk. (a) en tegneserie, der skildrer de mekanismer, der understøtter den kirotiske reaktion i ikke-opstillede og justerede tynde film, og (b) -
 Hybride indium-lithium anoder giver hurtig grænsefladeiontransportNye lithiumelektroder belagt med indium kunne være grundlaget for mere kraftfulde, længerevarende, genopladelige batterier. Belægningen forhindrer uønskede side-reaktioner mellem elektroden og elektro
Hybride indium-lithium anoder giver hurtig grænsefladeiontransportNye lithiumelektroder belagt med indium kunne være grundlaget for mere kraftfulde, længerevarende, genopladelige batterier. Belægningen forhindrer uønskede side-reaktioner mellem elektroden og elektro -
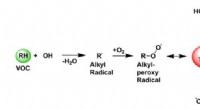 Identifikation af et undvigende molekyle nøgle til forbrændingskemiEt diagram, der viser, hvordan oxidationen af flygtige organiske forbindelser (VOC) kan forbruge og regenerere OH-radikaler. Et alkylradikal (R•) reagerer med oxygen og danner et alkylperoxyradikal
Identifikation af et undvigende molekyle nøgle til forbrændingskemiEt diagram, der viser, hvordan oxidationen af flygtige organiske forbindelser (VOC) kan forbruge og regenerere OH-radikaler. Et alkylradikal (R•) reagerer med oxygen og danner et alkylperoxyradikal -
 Forskere syntetiserer halvmetal uden magnetiseringSpinarrangement af magnetiske momenter i ferromagnetiske, antiferromagnetiske og ferrimagnetiske materialer. Kredit:Rie Umetsu En forskergruppe har med succes syntetiseret et halvmetal materiale og
Forskere syntetiserer halvmetal uden magnetiseringSpinarrangement af magnetiske momenter i ferromagnetiske, antiferromagnetiske og ferrimagnetiske materialer. Kredit:Rie Umetsu En forskergruppe har med succes syntetiseret et halvmetal materiale og
- NASA ser orkanen Jose mellem Bahamas og Bermuda
- Svampebaserede pesticider kan være fremtidens grønne løsning
- Forskning har til formål at styrke retfærdighedsoplevelsen for ofre for seksuel vold
- Sundhed eller levebrød? Lockdowns tvinger verdens fattigste til dødelige afvejninger
- Forskere ser molekyler i en lysudløst katalysatorring som et ensemble af klokker
- Twitters forbud mod politiske annoncer ændrer spillet på én måde


