Rogue enzymer forårsager adskillige sygdomme, men en ny metode kan hjælpe med at designe lægemidler til at behandle dem
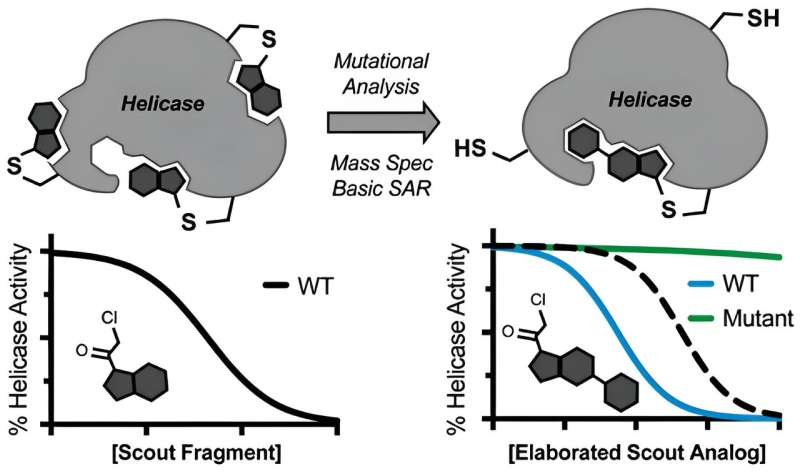
Helikaser er enzymer, der afvikler DNA og RNA. De er centrale for cellelivet, impliceret i en række kræftformer og infektioner – og desværre ekstraordinært vanskelige at målrette mod med medicin.
Nu giver ny forskning en kraftfuld platform til at designe kovalente inhibitorer skræddersyet til at målrette helikaser. Artiklen, offentliggjort i Journal of the American Chemical Society , beskriver, hvordan forskere brugte denne innovative nye platform til at designe molekyler, der tager sigte på helikaser involveret i COVID og visse kræftformer.
"Højopløselige strukturelle og biokemiske data alene er ikke tilstrækkelige til at finde lægelige steder i konformationelt dynamiske enzymer såsom helicaser," siger Rockefeller Universitys Tarun Kapoor. "Vores tilgang kan identificere disse steder og også give kemiske udgangspunkter for udvikling af lægemidler, der er målrettet mod helikaser."
Mekaniske vanskeligheder
Komplekse molekylære maskiner, der krydser DNA- og RNA-strenge, helikaser skal kickstarte den optrævlingsproces, der forbereder genetisk information til processer som replikation eller transkription. Men når helikaser bliver useriøse, kan de fremme væksten af nogle kræftformer. Samtidig er helikaser også afgørende for viral replikation og bakteriel spredning. Det følger heraf, at forskellige lægemidler rettet mod disse enzymer kunne behandle visse kræftformer eller stoppe infektioner i deres spor.
"Helikaser er meget varme mål lige nu," siger hovedforfatter Jared Ramsey, en kandidatstuderende i Kapoor-laboratoriet. "Lægemidler, der hæmmer helikaser, er af stor interesse for det videnskabelige samfund og kan udnyttes som nye og effektive behandlinger."
Helicasehæmmere er dog svære at få fat i. Ved at teste tusindvis af små molekyler har lægemiddelfirmaer lejlighedsvis fundet metoder til at slibe den ene eller anden helicase til standsning, men disse hændelser har vist sig sjældne. "Det samme var tilfældet i vores laboratorium," siger Ramsey. "Vi var ikke i stand til at identificere helikasehæmmere ved hjælp af typiske metoder såsom high-throughput screening."
Ramsey, Kapoor og kolleger undrede sig over, om elektrofile små molekyler kunne bruges til at udforske de svage punkter i en helicase og stille og roligt anspore enzymet til potentielle bindingssteder, der er modtagelige for lægemidler.
Centralt for denne idé er begrebet kovalens, hvor inhibitorkandidater irreversibelt binder helicase-målet, hvilket muligvis omgår komplikationer fra disse enzymers dynamiske og flydende natur. Til det formål udvalgte holdet to uskadelige molekyler og dirigerede de såkaldte spejderfragmenter mod en helicase af SARS-CoV-2.
Da de fandt sandsynlige bindingssteder på helicasen, forfremmede de spejderne til soldater. "Vi skulle bare tage et minimalt udviklet elektrofilt molekyle, identificere, hvor det binder med massespektrometri, og derefter bruge medicinsk kemi til at modificere det og screene et par versioner af for at opnå en potent, specifik inhibitor," siger Ramsey.
Holdet demonstrerede også, at spejderfragmenter kunne indstilles til at lukke ned for to specifikke helicaser, BLM og WRN, som er impliceret i henholdsvis Bloom syndrom og Werner syndrom samt en række kræftformer. Selvom de offentliggjorte resultater ikke umiddelbart forventes at blive omsat til lægemidler, der behandler COVID eller kræft, fungerer de som et værdifuldt udgangspunkt for lægemiddeludviklere til at lave skræddersyede helicase-mål.
"Vores resultater viser, hvordan den platform, vi udviklede, kunne fremskynde arbejdet i andre laboratorier," siger Ramsey. "Vi har en grundlæggende videnskabelig tilgang, og det er, hvor mange nyttige resultater bliver afdækket. Dette kræver et udfordrende problem og giver os et solidt sted at starte."
Flere oplysninger: Jared R. Ramsey et al., Using a Function-First "Scout Fragment"-based approach to Developing Allosteric Covalent Inhibitors of Conformationally Dynamic Helicase Mechanoenzymes, Journal of the American Chemical Society (2023). DOI:10.1021/jacs.3c10581
Leveret af Rockefeller University
 Varme artikler
Varme artikler
-
 Modifikation og nedbrydning af Ni-rige katodebaserede Li-ion-batterierKredit:Shutterstock Der er opnået enighed om behovet for at erstatte fossilt brændstof med vedvarende energikilder, og størstedelen af verdens lande forpligter sig til at realisere CO2-neutralite
Modifikation og nedbrydning af Ni-rige katodebaserede Li-ion-batterierKredit:Shutterstock Der er opnået enighed om behovet for at erstatte fossilt brændstof med vedvarende energikilder, og størstedelen af verdens lande forpligter sig til at realisere CO2-neutralite -
 Hvor grøn er din vandtætte jakke?Kredit:University of Leeds I lyset af uforudsigelige vejrforhold, vandtætte jakker er blevet nøgleelementer i mange menneskers garderober. Men ny forskning fra University of Leeds tyder på, at br
Hvor grøn er din vandtætte jakke?Kredit:University of Leeds I lyset af uforudsigelige vejrforhold, vandtætte jakker er blevet nøgleelementer i mange menneskers garderober. Men ny forskning fra University of Leeds tyder på, at br -
 Holdbare træsvampe fungerer som grønne sensorer for mekanisk belastningPå dette fotografi, en træ carbon svamp genopretter til sin oprindelige form efter komprimering. Kredit:Chen et al. Slå den helt rigtige balance mellem blødhed og robusthed, balsatræ er et valgmat
Holdbare træsvampe fungerer som grønne sensorer for mekanisk belastningPå dette fotografi, en træ carbon svamp genopretter til sin oprindelige form efter komprimering. Kredit:Chen et al. Slå den helt rigtige balance mellem blødhed og robusthed, balsatræ er et valgmat -
 Ruheden af en platinelektrode3-D stak af efterfølgende faser af runingen. Kredit:Leiden Universitet Glatte platinelektroder bliver ru og slides, når de udsættes for gentagne cyklusser af oxidation og reduktion, hvilket får hø
Ruheden af en platinelektrode3-D stak af efterfølgende faser af runingen. Kredit:Leiden Universitet Glatte platinelektroder bliver ru og slides, når de udsættes for gentagne cyklusser af oxidation og reduktion, hvilket får hø
- Åbner et nyt kapitel i antistofmimetik
- 'Vi er ikke blevet lært om sex':Teenagere taler om, hvordan man ordner skoleseksualundervisning
- En ny multifunktionel katalysator forvandler metan til værdifulde kulbrinter
- Vejret er det hotte emne, da tilskuere til formørkelse udvælger deres pladser i USA, Mexico og Can…
- Astrofysikere afgør kosmisk debat om magnetisme af planeter og stjerner
- Hvad har svarteorm og jordmormor til fælles?


