Forsker foreslår paradigmeskift i enzymbiokemi
Selvom du måske aldrig har hørt om cytokrom P450-superfamilien af enzymer, spiller disse proteiner forskellige og kritiske roller hos mennesker gennem metabolisk behandling af lægemidler, pesticider, fedtsyrer, fedtopløselige vitaminer og kemiske kræftfremkaldende stoffer og biosyntesen af essentielle steroider, inklusive steroler.
Steroler er en familie af kemiske forbindelser, der deler en central, ringformet struktur, og som er afgørende for livet for en lang række organismer. Det bedst kendte sterol hos mennesker er kolesterol, en nøglekomponent i vores cellemembran og et altid tilstedeværende punkt i lægers sind, i betragtning af at forhøjede kolesterolniveauer i blodet kan øge vores risiko for hjerte-kar-sygdomme.
Laboratoriet af Fred Guengerich, Tadashi Inagami, Ph.D. Professor i biokemi ved Vanderbilt University, har studeret cytochrome P450 i 50 år. I et nyt papir offentliggjort i Angewandte Chemie , undersøgte Guengerich-laboratoriet den mekanisme, der anvendes af cytochrom P450 51 - et P450-enzym, der findes i alle livsfamilier - for at katalysere en kritisk tretrinsreaktion i sterolbiosyntesen:metabolismen af lanosterol.
"Dette har været et udfordrende, men givende projekt, der giver det første utvetydige svar på et mangeårigt og kontroversielt mekanistisk spørgsmål inden for eukaryot sterolbiosyntese," sagde hovedforfatter og biokemistuderende Kevin McCarty.
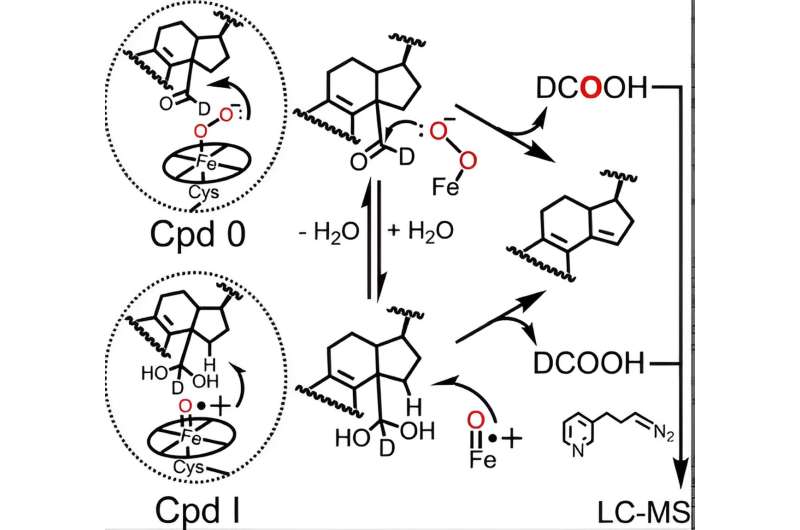
Den katalytiske cyklus af alle P450-enzymer involverer dannelsen af to aktive hæmjernarter - Forbindelse 0 og Forbindelse I, hvoraf sidstnævnte er naturligt dannet af Forbindelse 0 - som er nødvendige for P450-katalyserede reaktioner, herunder lanosterolmetabolisme. Selvom forbindelse I's rolle i de første to trin af lanosterolmetabolisme er veletableret, har modstridende data fra forskellige laboratorier efterladt videnskabsmænd uklare om, hvorvidt P450 51 bruger forbindelse 0 eller forbindelse I til at udføre det afgørende sidste trin.
Ved at bruge en avanceret analytisk teknik, oprindeligt raffineret af den tidligere Guengerich postdoc Francis Yoshimoto, som sporer inkorporeringen af en oxygenisotop kaldet 18 O ind i produkterne fra P450-reaktionen er McCarty og kolleger blevet de første til at foreslå, at både forbindelse 0 og forbindelse I kan spille aktive kemiske roller i det sidste trin af lanosterolmetabolismen.
Faktisk, resultater præsenteret i Angewandte Chemie papir indikerer, at mens forbindelse 0 er den vigtigste hæm-art, der er ansvarlig for det sidste trin af human P450 51's katalytiske virkning (~85% af reaktionen), spiller forbindelse I stadig en mindre, kvantificerbar rolle (~14% af reaktionen).
I samarbejde med Galina Lepesheva, forskningsprofessor i biokemi, sammenlignede forskerne de relative bidrag fra hver hæm-art i fire P450 51-enzymer fra patogen gær, amøber og trypanosomer, en type parasit, til den menneskelige ortolog. Mens gær- og amøbe-enzymer viste lignende resultater som det humane protein, afslørede resultaterne fra de trypanosomale enzymer en interessant mekanistisk forskel:Forbindelse 0 og forbindelse I delte nogenlunde lige store bidrag til reaktionen.
Disse resultater tilføjer dybde til vores kollektive og mekanistiske forståelse af P450-enzymer, specifikt dem, der er involveret i sterolbiosyntese.
"Dette var et langt projekt, der krævede en 17-trins kemisk syntese, fem forskellige oprensede P450 51 enzymer fra vores samarbejdspartner Prof. Galina Lepesheva, meget omhyggelig opmærksomhed på at bruge en 18-ilt atmosfære i reaktionerne, sofistikeret højopløsnings massespektrometri, og omhyggeligt arbejde af alle forfatterne i vores laboratorium," sagde Guengerich. Ifølge ham tillod hans teams opmærksomhed på detaljer det at "knække dette system" og give en klar analyse af en todelt enzymmekanisme.
"Vores resultater giver et vigtigt fremskridt i forståelsen af P450 51-funktionen hos mennesker og forskellige patogener, som vi håber vil være nyttige i den fortsatte søgning efter P450 51-målrettede lægemidler," sagde McCarty.
I øjeblikket hæmmer en række eksisterende antifungale lægemidler svampe P450 51 enzymer for at forstyrre organismens evne til at lave essentielle steroler og formere sig. Alligevel understreger resistens over for svampemidler, kombineret med eksistensen af livstruende svampeinfektioner, som der ikke er nogen behandling for, det fortsatte behov for nye P450 51-målrettede lægemidler.
Ser frem til, vil Guengerich og Lepesheva-laboratorierne yderligere analysere et P450 51-enzym fra amøbe på jagt efter mekanistiske ejendommeligheder, der kan udnyttes som potentielle lægemiddelmål.
Flere oplysninger: Kevin D. McCarty et al., Oxygen-18-mærkning afslører en blandet Fe-O-mekanisme i det sidste trin af Cytochrom P450 51 Sterol 14α-Demethylation, Angewandte Chemie International Edition (2024). DOI:10.1002/anie.202317711
Leveret af Vanderbilt University
 Varme artikler
Varme artikler
-
 Kræftceller kan kommunikere over længere afstande i kroppenKredit:Ecole Polytechnique Federale de Lausanne EPFL-forskere har opdaget, at kræftceller bruger exosomer til at kommunikere med hinanden og sende information gennem blodbanen. Dette gennembrud åb
Kræftceller kan kommunikere over længere afstande i kroppenKredit:Ecole Polytechnique Federale de Lausanne EPFL-forskere har opdaget, at kræftceller bruger exosomer til at kommunikere med hinanden og sende information gennem blodbanen. Dette gennembrud åb -
 Nyt substrat til dyb UV-overfladeforstærket resonans Raman-spredningSkematisk billede af enkeltstrenget DNA på aluminiumshullerne i et SERRS-substrat, der er bestrålet med DUV-lys. Kredit:National Tsing Hua University Den ekstreme nøjagtighed og hastighed af NBA-tr
Nyt substrat til dyb UV-overfladeforstærket resonans Raman-spredningSkematisk billede af enkeltstrenget DNA på aluminiumshullerne i et SERRS-substrat, der er bestrålet med DUV-lys. Kredit:National Tsing Hua University Den ekstreme nøjagtighed og hastighed af NBA-tr -
 Kemikere får et glimt af en reaktions flygtige overgangstilstandKredit:CC0 Public Domain Under en kemisk reaktion, molekylerne involveret i reaktionen får energi, indtil de når et point of no return, kendt som en overgangstilstand. Indtil nu, ingen har skimte
Kemikere får et glimt af en reaktions flygtige overgangstilstandKredit:CC0 Public Domain Under en kemisk reaktion, molekylerne involveret i reaktionen får energi, indtil de når et point of no return, kendt som en overgangstilstand. Indtil nu, ingen har skimte -
 Ny syntetisk protokol til dannelse af 3-D porøst organisk netværkSolid-state eksplosion af bulk HEA krystaller. Kredit:UNIST Et team af koreanske forskere tilknyttet UNIST har for nylig annonceret princippet om at producere porøse organiske materialer på et øje
Ny syntetisk protokol til dannelse af 3-D porøst organisk netværkSolid-state eksplosion af bulk HEA krystaller. Kredit:UNIST Et team af koreanske forskere tilknyttet UNIST har for nylig annonceret princippet om at producere porøse organiske materialer på et øje
- NASA-NOAAs Suomi NPP analyserer rekordstærk orkan Lorenzo
- Nyligt observeret monovalent calciumion viser uventet metallicitet og ferromagnetisme
- American Airlines ansøger om 12 mia. USD i statsstøtte
- Første Jurassic ichthyosaur fossil fundet i Indien
- Indien lider under det varmeste årti nogensinde
- Nye hafniumpolyhydrider, superledende over 80 K


