Styrker nitrogenaser:Forskere finder nye mål for forbedring af biokatalysatorer
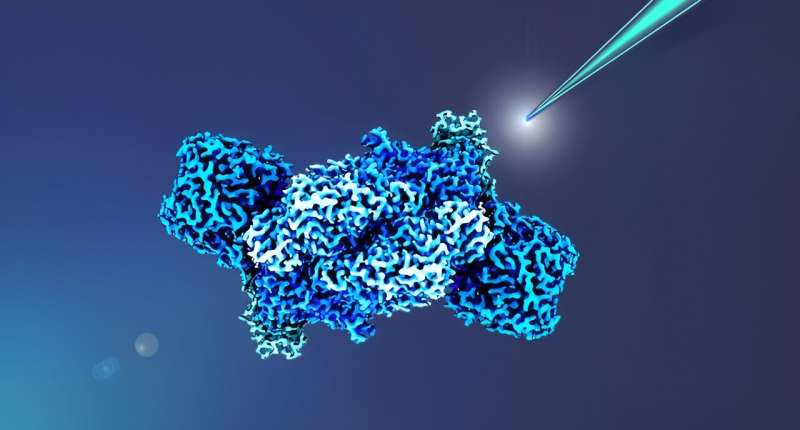
Nitrogenaser betragtes som lovende kandidater til bæredygtig enzymatisk produktion af ammoniak og kulstofforbindelser. Desværre har en flaskehals i denne komplekse proces, forsyningen af elektroner til enzymerne, forblevet et mysterium indtil nu.
Et hold ved Max Planck Institute for Terrestrial Microbiology i Marburg har opdaget to essentielle elektronbærere, der spiller en nøglerolle i at bestemme ydeevnen af jern (Fe) nitrogenase og dermed åbne nye muligheder for at belyse og maksimere nitrogenases potentiale. Resultaterne er publiceret i tidsskriftet mBio .
Nitrogenaser er katalysatorer for flere industrielt relevante reaktioner, hvoraf den vigtigste er den kemiske fiksering og omdannelse af nitrogen til ammoniak, et råmateriale til gødning. Deres industrielle produktion udføres i øjeblikket ved hjælp af den miljøskadelige Haber-Bosch-proces.
Enzymatisk og bæredygtigt produceret gødning kan spare omkring 1 % af den energi, der forbruges globalt, og den tilhørende kuldioxid, der frigives, hvilket er grunden til, at mange forskningslaboratorier og nystartede virksomheder fokuserer på emnet. Imidlertid er nitrogenaseforskning udfordrende, fordi nitrogenaser er meget komplekse metalloenzymer, og mange aspekter af deres reaktivitet og katalyse er stadig dårligt forstået.
Jernnitrogenase fikserer ikke kun nitrogen, men også kuldioxid
Forskere ledet af Johannes Rebelein ved Max Planck Institute for Terrestrial Microbiology i Marburg, Tyskland, har nu fået første indsigt i energiforsyningen af enzymkomplekset, dvs. dets elektronforsyning.
Deres resultater er vigtige ikke kun for industriel nitrogen, men også for industriel kuldioxidfiksering, fordi det samme hold for nylig viste, at jernnitrogenaser også er i stand til at omdanne kuldioxid til kortkædede kulbrinter. Forskerne karakteriserede elektrontransporten til jernnitrogenasen i modelbakterien Rhodobacter capsulatus og viste, at to forskellige elektrontransportproteiner, kaldet ferredoxiner, er essentielle for nitrogenfiksering.
Energiflaskehalsen åbner op for nye tilgange til optimering
"Vi ville finde ud af, hvilke ferredoxiner der er afgørende for nitrogenasekatalyse. Da alle celler rummer flere ferredoxiner, hvor vores modelbakterie R. capsulatus producerer seks forskellige ferredoxiner, ville vi også finde ud af, om flere af disse ferredoxiner kan udføre den samme opgave eller om de har strengt specifikke funktioner," forklarer førsteforfatter Holly Addison.
"Da to specifikke ferredoxiner blev slået ud, kunne de andre ikke overtage deres funktioner. Vi konkluderede, at disse ferredoxiner var essentielle og sandsynligvis spillede forskellige roller i nitrogenfiksering."
Forsyningen af elektroner betragtes som en flaskehals i katalyse. Med de to ferredoxiner har forskerne nu identificeret klare mål for at påvirke elektronstrømmen og dermed ydeevnen af nitrogenaser som biokatalysatorer.
"Vores resultater er en vigtig forudsætning for optimeringen af R. capsulatus som et modelsystem til øget omdannelse af nitrogen eller kuldioxid til ammoniak eller kortkædede kulbrinter," tilføjer Johannes Rebelein.
"Målet er nu at undersøge og konstruere nitrogenaser og deres tilknyttede proteiner for at udvide vores forståelse og muliggøre produktion af industrielle bulkemikalier."
De næste trin i projektet vil fokusere på en bedre forståelse af ferredoxiners rolle samt at bruge syntetiske biologiske metoder til at modificere dem og accelerere omsætningen af nitrogenaseenzymet ved at levere elektroner mere effektivt.
Flere oplysninger: Holly Addison et al., To forskellige ferredoxiner er afgørende for nitrogenfiksering af jernnitrogenasen i Rhodobacter capsulatus, mBio (2024). DOI:10.1128/mbio.03314-23
Leveret af Max Planck Society
 Varme artikler
Varme artikler
-
 Forskning i havvands overfladespænding bliver international retningslinjeOverfladespænding er vandets egenskab, der gør det muligt for insekter at skumme vandoverfladen. Forskning udført af John Lienhard og Kishor Nayar for at forstå, hvordan havvandets overfladespænding æ
Forskning i havvands overfladespænding bliver international retningslinjeOverfladespænding er vandets egenskab, der gør det muligt for insekter at skumme vandoverfladen. Forskning udført af John Lienhard og Kishor Nayar for at forstå, hvordan havvandets overfladespænding æ -
 Brintforskning giver næring til nye solenergiideer til grøn energiCurtin Universitys Dr Guohua Jia. Kredit:Curtin University Ny forskning ledet af Curtin University udforsker brugen af methanol som et lager for brintbrændstof, at give en potentiel grøn mulighe
Brintforskning giver næring til nye solenergiideer til grøn energiCurtin Universitys Dr Guohua Jia. Kredit:Curtin University Ny forskning ledet af Curtin University udforsker brugen af methanol som et lager for brintbrændstof, at give en potentiel grøn mulighe -
 Forskere gør plastik mere nedbrydeligt under UV-lysKredit:Unsplash/CC0 Public Domain Mange plastiktyper, der er mærket som biologisk nedbrydelige, er kun komposterbare under industrielle forhold, men forskere ved University of Bath har nu fundet en
Forskere gør plastik mere nedbrydeligt under UV-lysKredit:Unsplash/CC0 Public Domain Mange plastiktyper, der er mærket som biologisk nedbrydelige, er kun komposterbare under industrielle forhold, men forskere ved University of Bath har nu fundet en -
 UNTs moderne alkymist tager de første skridt mod at omdanne metan til methanolMetan (til venstre) består af et kulstofatom omgivet af fire brintatomer. Methanol (til højre) ligner metan, men har et oxygenatom mellem et af hydrogenatomerne og carbonatomet. Kredit:UNT At find
UNTs moderne alkymist tager de første skridt mod at omdanne metan til methanolMetan (til venstre) består af et kulstofatom omgivet af fire brintatomer. Methanol (til højre) ligner metan, men har et oxygenatom mellem et af hydrogenatomerne og carbonatomet. Kredit:UNT At find
- Europas brande forværres, selvom klimamålene nås:undersøgelse
- James Webb rumteleskop fuldfører akustiske og vibrationstests
- Undersøgelse af virkningerne af globale chok på udviklingen af en sammenkoblet verden
- Mens NASAs Cassini-mission flammer ud over Saturn, videnskabsmænd markerer den bittersøde afslutni…
- Nøgle-gætte blockchain-bandit er opdaget i sikkerhedsforskning
- USA er den største kulstofudleder i historien. Hvor står andre nationer?


