Ny klasse af intramolekylær bivalent lim kunne transformere opdagelsen af kræftlægemidler
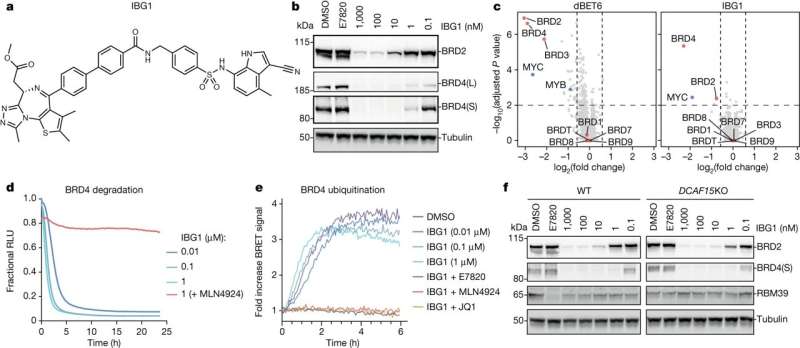
En banebrydende klasse af molekylær lim identificeret ved University of Dundee kan bane vejen for en ny generation af lægemidler til at målrette kræftformer og neurodegenerative sygdomme.
Et forskerhold ved universitetets center for målrettet proteinnedbrydning (CeTPD) ledet af professor Alessio Ciulli i samarbejde med forskergruppen af Dr. Georg Winter ved forskningscentret for molekylær medicin (CEMM) ved det østrigske videnskabsakademi i Wien, har defineret en ny klasse af såkaldt "intramolekylær bivalent lim", som binder proteiner – afgørende for de celler, der tillader vores kroppe at fungere korrekt – som ellers ville holde sig fra hinanden.
Denne forskning er blevet publiceret i tidsskriftet Nature .
"Disse resultater har store implikationer for hele den farmaceutiske industri, der er engageret i målrettede proteinnedbrydere," sagde professor Alessio Ciulli, direktør for Dundee's CeTPD.
"Dette gælder især for udviklingen af lægemidler, der er rettet mod kræft, neurodegenerative sygdomme og mange flere sygdomme drevet af proteiner, som altid har været anset for at være udugelig."
"Proteiner er afgørende for, at vores celler fungerer korrekt, men når disse ikke fungerer korrekt, er kroppen sårbar over for sygdom."
"Den lim, som vi har været i stand til at definere, er speciel, fordi den først binder sig til ét protein to steder - ikke kun ét - og derefter rekrutterer det andet protein, der effektivt klemmer de to proteiner sammen."
"Vi har kun været i stand til at identificere dette ved hjælp af vores målrettede proteinnedbrydningsteknologi og har identificeret en sårbarhed, som kan udnyttes ved udformningen af nye lægemidler, der potentielt kan transformere behandling for kræftpatienter og dem med andre sygdomme, der ikke kan behandles."
Målrettet proteinnedbrydning (TPD) er et spirende område inden for lægemiddeludvikling til behandling af sygdomme, der involverer omdirigering af proteingenbrugssystemer i vores celler for at ødelægge sygdomsfremkaldende proteiner. De fleste TPD-strategier bruger små molekyler - såkaldte nedbrydere - til at rekruttere disse målproteiner til en klasse af enzymer kaldet ubiquitin E3-ligaser.
E3 mærker målproteinet med ubiquitin-mærker, hvilket i sidste ende fører til ødelæggelsen af det sygdomsfremkaldende protein via den cellulære affaldsbeholder:proteasomet.
I samarbejde med samarbejdspartnere på CEMM, Goethe Universitetet i Frankfurt og Eisai Co. Ltd, det japanske medicinalfirma, har Dundee-teamet været i stand til at afsløre en ny mekanisme til molekylær limning, der er forskellig fra de tidligere kendte. Denne nye mekanisme binder sig til to sider af målproteinet i stedet for kun én, hvilket medfører en omarrangering af hele proteinet og stabiliserer dets hidtil ukendte interaktion med E3-ligasen.
Desuden var holdet i stand til for første gang at visualisere den præcise mekanisme, hvormed deres forbindelser virker, og samle målproteinerne til en af disse E3-ligaser. Fordi molekylerne har to hoveder, som hænger fast på to forskellige områder inden for det samme målprotein, er disse blevet opfundet som "intramolekylære bivalente lime."
Dette verdensførende arbejde har også belyst tidligere undervurderede egenskaber og egenskaber ved molekylære lime, hvilket har banet vejen for videnskabsmænd til at udvikle en dybere forståelse af lim, der kunne gøre det muligt at opdage nye klasser hurtigere.
"Virkningen af det, vi har afsløret her, kan ikke undervurderes," tilføjede professor Ciulli. "Dette vil forårsage en ringvirkning i hele den farmaceutiske industri og har potentialet til at transformere, hvordan vi ser på lægemiddeludvikling. Jeg skal også hylde vores samarbejdspartnere, hvis input har været afgørende for at opnå dette seismiske gennembrud."
Flere oplysninger: Alessio Ciulli, Målrettet proteinnedbrydning via intramolekylære bivalente gener, Nature (2024). DOI:10.1038/s41586-024-07089-6. www.nature.com/articles/s41586-024-07089-6
Leveret af University of Dundee
 Varme artikler
Varme artikler
-
 En billigere måde at opskalere atomlagsaflejring påKunstnerisk illustration af atomlagsaflejring. Kredit:J. Luterbacher Kemiingeniører ved EPFL har udviklet en ny metode til atomlagsaflejring, en teknik, der almindeligvis anvendes i mikroelektroni
En billigere måde at opskalere atomlagsaflejring påKunstnerisk illustration af atomlagsaflejring. Kredit:J. Luterbacher Kemiingeniører ved EPFL har udviklet en ny metode til atomlagsaflejring, en teknik, der almindeligvis anvendes i mikroelektroni -
 Metaller supplerer en lovende metode til at begrave skadeligt kuldioxid under havetKredit:CC0 Public Domain Der er en global race om at reducere mængden af skadelige gasser i vores atmosfære for at bremse tempoet i klimaændringer, og en måde at gøre det på er gennem kulstofops
Metaller supplerer en lovende metode til at begrave skadeligt kuldioxid under havetKredit:CC0 Public Domain Der er en global race om at reducere mængden af skadelige gasser i vores atmosfære for at bremse tempoet i klimaændringer, og en måde at gøre det på er gennem kulstofops -
 Personale på Berkeley Labs X-Ray-facilitet mobiliserer for at støtte COVID-19-relateret forskningDen kuppelformede Advanced Light Source (ALS) bygning på Berkeley Lab, og det nærliggende UC Berkeley campus, er synlige på dette dronebillede taget i marts 2020. ALS er genåbnet for at udføre COVID-1
Personale på Berkeley Labs X-Ray-facilitet mobiliserer for at støtte COVID-19-relateret forskningDen kuppelformede Advanced Light Source (ALS) bygning på Berkeley Lab, og det nærliggende UC Berkeley campus, er synlige på dette dronebillede taget i marts 2020. ALS er genåbnet for at udføre COVID-1 -
 Justering af nøjagtige forhold mellem to metaller i en katalysator kan muliggøre nye retninger ind…Michael Janik (til venstre), professor i kemiteknik i Penn State, og Robert Rioux, professor i kemiteknik fra Penn State, Friedrich G. Helfferich, udgav et Nature Chemistry-papir, hvori de testede eff
Justering af nøjagtige forhold mellem to metaller i en katalysator kan muliggøre nye retninger ind…Michael Janik (til venstre), professor i kemiteknik i Penn State, og Robert Rioux, professor i kemiteknik fra Penn State, Friedrich G. Helfferich, udgav et Nature Chemistry-papir, hvori de testede eff
- Styrkerne bag Syd- og Central -Chinas ekstremt varme sommer
- Undersøgelsen har til formål at kortlægge luftforurening foran vores ansigter
- Kun én ud af tre piger når gymnasiet Senegal:Her er hvorfor og hvordan man løser problemet
- Nyt scenarie for kollisionsdynamikken mellem Indien og Asien
- E.coli en fremtidig energikilde?
- Bygger rovere, der kan opdage liv og sekvensere DNA på andre verdener


