Opdagelse af ny planteproteinfold kan være frø til anti-cancermedicin
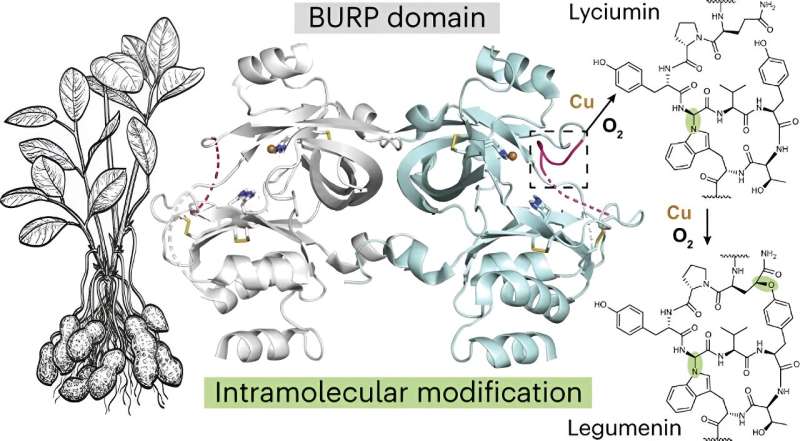
Forskere fra University of Michigan fejrer deres opdagelse af en ny plantebiokemi og dens usædvanlige evne til at danne cykliske peptider - molekyler, der lover i lægemidler, da de kan binde sig til udfordrende lægemiddelmål.
Cykliske peptider er et spirende og lovende område inden for lægemiddelforskning.
Den nye undersøgelse, ledet af UM College of Pharmacy-forskerne Lisa Mydy og Roland Kersten, afslørede en mekanisme, hvorved planter genererer cykliske peptider. Forskningen er publiceret i tidsskriftet Nature Chemical Biology .
Mydy identificerede den nye planteproteinfold og dens nye kemi, som hun sagde aldrig var set før. Proteinet kan generere cykliske peptider, hvoraf et har potentiale som et lægemiddel mod kræft.
"Det er ekstremt spændende," sagde Mydy, en postdoc-stipendiat ved Institut for Medicinalkemi. "Denne type opdagelse sker ikke for ofte."
Mydy og kolleger undersøgte biosyntesen af en klasse af makrocykliske peptider fundet i planter og kendt for deres potentielle brug som terapeutiske lægemidler. De identificerede en "fascinerende ny proteinfold, der har en virkelig usædvanlig mekanisme til at danne cykliske peptider. Det er en ny biokemi, som vi ikke har set før," sagde Mydy.
Forskerne undersøgte også peptidcyclase, et protein kaldet AhyBURP, der findes i rødderne af jordnøddeplanten, en repræsentant for det grundlæggende Unknown Seed Protein, eller USP-typen, som igen er en del af BURP-domæneproteinfamilien.
"Der var ingen eksperimentel information om vores protein AhyBURP," sagde Mydy. "Det eneste tip, vi havde til funktion var, at proteinet havde brug for kobber for at cyklisere et peptid."
Forskerholdet studerede proteinstrukturerne med røntgenkrystallografi og brugte Advanced Photon Source på Argonne National Laboratory. I processen fandt de ud af, at "proteinet AhyBURP bruger kobber og ilt på en unik måde, som vi stadig er ved at undersøge," sagde Mydy.
"De fleste cykliske peptider har brug for et andet enzym for at komme ind og udføre cykliseringskemien," sagde hun. "AhyBURP kan dog gøre det inden for det samme protein på sig selv. Andre kobberafhængige proteiner fungerer ved at binde oxygen et sted på peptidet. Det observerer vi ikke, og vi vil gerne vide hvorfor. Jeg ser dette som det første eksempel på denne type kemi, der kan ske med kobber og ilt i et protein."
Opdagelsen af det nye protein voksede fra igangværende arbejde i Kerstens laboratorium. Som en del af U-M Natural Product Discovery Initiative sigter Kersten-laboratoriet på at opdage og forske i nye plantebaserede kemikalier, der kan blive til lægemidler og i sidste ende helbrede menneskelige sygdomme.
"Vi bruger en moderne tilgang, hvor vi screener planters genetiske sekvenser, søger efter gener forbundet med ny kemi," sagde Kersten, assisterende professor i medicinsk kemi ved College of Pharmacy. "Det er sådan, vi identificerede de cykliske peptidprodukter og deres underliggende proteiner som et mål af interesse."
Denne klasse af peptider er af interesse, fordi deres cykliseringsegenskaber gør dem mere strukturerede og stabile, hvilket øger deres potentiale til at blive brugt som lægemidler.
Mange lægemidler, herunder kemikalier afledt af levende organismer, er cykliske, hvilket betyder, at de kan binde lægemiddelmål og forblive intakte i en patient i et ønsket tidsrum. Naturen har udviklet mange biokemiske løsninger til at producere sådanne cykliske molekyler.
Kersten har isoleret andre forbindelser fremstillet af den samme proteinfamilie, som har vist sig at have en undertrykkende effekt på lungekræftceller i laboratorietests, så der er voksende håb om, at denne opdagelse vil have potentiale som et fremtidigt anti-cancermiddel.
"Nu hvor vi ved, hvordan proteinet ser ud for et af BURP-domæneproteinerne, kan vi teste flere ideer om, hvordan proteinet kan påvirke den kemiske reaktion mellem peptidet, kobberet og oxygenet til at danne cykliske peptider," sagde Mydy, en strukturbiolog og enzymolog af uddannelse.
"Det er et fantastisk og udfordrende puslespil at finde ud af, hvorfor dette sker og forstå strukturen. Det er ekstremt spændende at være en del af denne type opdagelse, der i sidste ende kan føre til effektive farmaceutiske terapier."
Flere oplysninger: Lisa S. Mydy et al., An intramolecular macrocyclase in plant ribosomal peptide biosynthesis, Nature Chemical Biology (2024). DOI:10.1038/s41589-024-01552-1
Leveret af University of Michigan
 Varme artikler
Varme artikler
-
 Ny metode lover færre bivirkninger fra kræftmedicinHis-tag acylering kan præcist målrette komplekse garnlignende proteinstrukturer og gør det også muligt at producere lægemidler med helt nye egenskaber. Kredit:Pexels Proteinforskning er et af de h
Ny metode lover færre bivirkninger fra kræftmedicinHis-tag acylering kan præcist målrette komplekse garnlignende proteinstrukturer og gør det også muligt at producere lægemidler med helt nye egenskaber. Kredit:Pexels Proteinforskning er et af de h -
 Teknik til at skabe medicin fri for bivirkningerJ. Julius Zhu sagde, at hovedideen bag forskningen var faktisk meget enkel, men det tog os mange år at få denne ting til at fungere. Kredit:Dan Addison, Universitetets kommunikation En ny teknik
Teknik til at skabe medicin fri for bivirkningerJ. Julius Zhu sagde, at hovedideen bag forskningen var faktisk meget enkel, men det tog os mange år at få denne ting til at fungere. Kredit:Dan Addison, Universitetets kommunikation En ny teknik -
 Den grundlæggende kemi bag elektrokatalytisk vandspaltningOxygen evolution reaktion. Kredit:Matthias Frei, ETH Zürich Overgang til en bæredygtig energiøkonomi kræver elektrokatalytiske metoder til at konvertere elektrisk energi til kemisk energi og råsto
Den grundlæggende kemi bag elektrokatalytisk vandspaltningOxygen evolution reaktion. Kredit:Matthias Frei, ETH Zürich Overgang til en bæredygtig energiøkonomi kræver elektrokatalytiske metoder til at konvertere elektrisk energi til kemisk energi og råsto -
 Spændende ny udvikling for polymerer fremstillet af affaldssvovlHavnefrontens svovlbunke om natten, Vancouver havn. Kredit:University of Liverpool Forskere ved University of Liverpool gør betydelige fremskridt i søgen efter at udvikle nye svovlpolymerer, der g
Spændende ny udvikling for polymerer fremstillet af affaldssvovlHavnefrontens svovlbunke om natten, Vancouver havn. Kredit:University of Liverpool Forskere ved University of Liverpool gør betydelige fremskridt i søgen efter at udvikle nye svovlpolymerer, der g


