Undersøgelse afslører en reaktion i hjertet af mange vedvarende energiteknologier
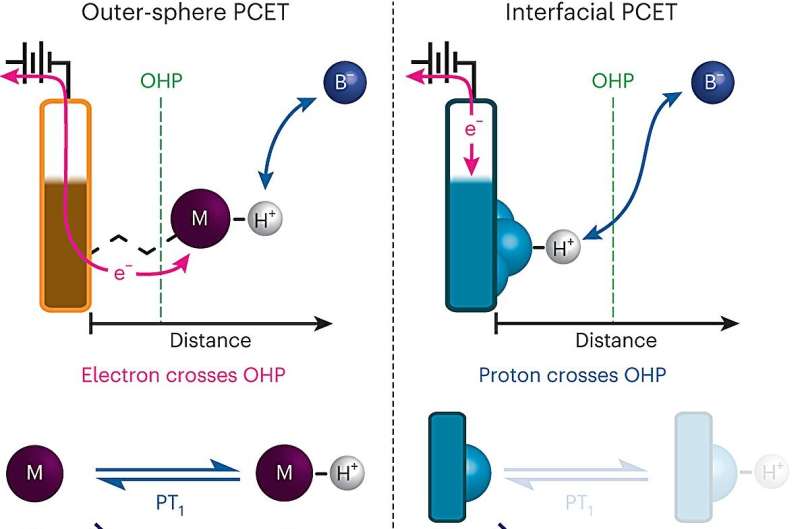
En vigtig kemisk reaktion – hvor bevægelsen af protoner mellem overfladen af en elektrode og en elektrolyt driver en elektrisk strøm – er et kritisk trin i mange energiteknologier, herunder brændselsceller og de elektrolysatorer, der bruges til at producere brintgas.
For første gang har MIT-kemikere kortlagt i detaljer, hvordan disse protonkoblede elektronoverførsler sker ved en elektrodeoverflade. Deres resultater kan hjælpe forskere med at designe mere effektive brændselsceller, batterier eller andre energiteknologier.
Forskningspapiret er publiceret i tidsskriftet Nature Chemistry .
"Vores fremskridt i denne artikel var at studere og forstå arten af, hvordan disse elektroner og protoner kobles på et overfladested, hvilket er relevant for katalytiske reaktioner, der er vigtige i forbindelse med energikonverteringsanordninger eller katalytiske reaktioner," siger Yogesh Surendranath, en professor i kemi og kemiteknik ved MIT og seniorforfatter til undersøgelsen.
Blandt deres resultater var forskerne i stand til at spore præcis, hvordan ændringer i pH-værdien af elektrolytopløsningen, der omgiver en elektrode, påvirker hastigheden af protonbevægelse og elektronstrøm i elektroden.
MIT kandidatstuderende Noah Lewis er hovedforfatter af papiret. Ryan Bisbey, en tidligere MIT postdoc; Karl Westendorff, en MIT kandidatstuderende; og Alexander Soudackov, en forsker ved Yale University, er også forfattere til papiret.
Passerende protoner
Protonkoblet elektronoverførsel opstår, når et molekyle, ofte vand eller en syre, overfører en proton til et andet molekyle eller til en elektrodeoverflade, hvilket stimulerer protonacceptoren til også at optage en elektron. Denne form for reaktion er blevet udnyttet til mange energianvendelser.
"Disse protonkoblede elektronoverførselsreaktioner er allestedsnærværende. De er ofte nøgletrin i katalytiske mekanismer og er særligt vigtige for energiomdannelsesprocesser såsom brintgenerering eller brændselscellekatalyse," siger Surendranath.
I en brintgenererende elektrolysator bruges denne tilgang til at fjerne protoner fra vand og tilføje elektroner til protonerne for at danne brintgas. I en brændselscelle genereres elektricitet, når protoner og elektroner fjernes fra brintgas og tilsættes ilt for at danne vand.
Protonkoblet elektronoverførsel er almindelig i mange andre typer kemiske reaktioner; for eksempel kuldioxidreduktion (omdannelsen af kuldioxid til kemiske brændstoffer ved at tilføje elektroner og protoner). Forskere har lært meget om, hvordan disse reaktioner opstår, når protonacceptorerne er molekyler, fordi de præcist kan kontrollere strukturen af hvert molekyle og observere, hvordan elektroner og protoner passerer mellem dem.
Men når protonkoblet elektronoverførsel finder sted ved overfladen af en elektrode, er processen meget sværere at studere, fordi elektrodeoverflader normalt er meget heterogene med mange forskellige steder, som en proton potentielt kan binde til.
For at overvinde denne forhindring udviklede MIT-teamet en måde at designe elektrodeoverflader på, der giver dem meget mere præcis kontrol over sammensætningen af elektrodeoverfladen. Deres elektroder består af plader af grafen med organiske, ringholdige forbindelser fastgjort til overfladen. For enden af hvert af disse organiske molekyler er en negativt ladet oxygenion, der kan acceptere protoner fra den omgivende opløsning, hvilket får en elektron til at strømme fra kredsløbet ind i den grafitiske overflade.
"Vi kan skabe en elektrode, der ikke består af en bred mangfoldighed af steder, men er en ensartet række af en enkelt type meget veldefinerede steder, der hver kan binde en proton med samme affinitet," siger Surendranath. "Da vi har disse meget veldefinerede websteder, var det, det gjorde, at vi virkelig kunne optrevle kinetikken i disse processer."
Ved hjælp af dette system var forskerne i stand til at måle strømmen af elektrisk strøm til elektroderne, hvilket gjorde det muligt for dem at beregne hastigheden af protonoverførsel til iltionen ved overfladen ved ligevægt - tilstanden når hastigheden af protondonation til overfladen og protonoverførsel tilbage til opløsning fra overfladen er lige store. De fandt ud af, at pH-værdien af den omgivende opløsning har en signifikant effekt på denne hastighed:De højeste hastigheder forekom i de ekstreme ender af pH-skalaen - pH 0, den mest sure, og pH 14, den mest basale.
For at forklare disse resultater udviklede forskere en model baseret på to mulige reaktioner, der kan forekomme ved elektroden. I den første, hydroniumioner (H 3 O + ), som er i høj koncentration i stærkt sure opløsninger, leverer protoner til overfladens oxygenioner og genererer vand. I den anden leverer vand protoner til overfladens oxygenioner, hvilket genererer hydroxidioner (OH - ), som er i høj koncentration i stærkt basiske opløsninger.
Imidlertid er hastigheden ved pH 0 omkring fire gange hurtigere end hastigheden ved pH 14, til dels fordi hydronium afgiver protoner hurtigere end vand.
En reaktion til genovervejelse
Forskerne opdagede også, til deres overraskelse, at de to reaktioner har ens hastigheder ikke ved neutral pH 7, hvor hydronium- og hydroxidkoncentrationer er ens, men ved pH 10, hvor koncentrationen af hydroxidioner er 1 million gange koncentrationen af hydronium. Modellen antyder, at dette skyldes, at den fremadrettede reaktion, der involverer protondonation fra hydronium eller vand, bidrager mere til den samlede hastighed end den tilbagegående reaktion, der involverer protonfjernelse med vand eller hydroxid.
Eksisterende modeller for, hvordan disse reaktioner opstår ved elektrodeoverflader, antager, at de fremadrettede og bagudgående reaktioner bidrager lige meget til den samlede hastighed, så de nye resultater tyder på, at disse modeller muligvis skal genovervejes, siger forskerne.
"Det er standardantagelsen, at de fremadrettede og omvendte reaktioner bidrager lige meget til reaktionshastigheden," siger Surendranath. "Vores fund er virkelig øjenåbnende, fordi det betyder, at den antagelse, som folk bruger til at analysere alt fra brændselscellekatalyse til brintudvikling, kan være noget, vi skal genoverveje."
Forskerne bruger nu deres eksperimentelle opsætning til at undersøge, hvordan tilsætning af forskellige typer ioner til elektrolytopløsningen, der omgiver elektroden, kan fremskynde eller sænke hastigheden af protonkoblet elektronstrøm.
"Med vores system ved vi, at vores websteder er konstante og ikke påvirker hinanden, så vi kan læse, hvad ændringen i løsningen gør ved reaktionen ved overfladen," siger Lewis.
Flere oplysninger: Noah B. Lewis et al., Mekanistisk ramme på molekylært niveau for grænsefladeprotonkoblet elektronoverførselskinetik, Nature Chemistry (2024). DOI:10.1038/s41557-023-01400-0
Journaloplysninger: Naturkemi
Leveret af Massachusetts Institute of Technology
Denne historie er genudgivet med tilladelse fra MIT News (web.mit.edu/newsoffice/), et populært websted, der dækker nyheder om MIT-forskning, innovation og undervisning.
 Varme artikler
Varme artikler
-
 Video:Er vi ved at løbe tør for helium?Kredit:The American Chemical Society Vidste du, at ligesom visse dyr her på Jorden, der er truede elementer, også? For eksempel, vi mister konstant helium, en gas, der trodser tyngdekraften og und
Video:Er vi ved at løbe tør for helium?Kredit:The American Chemical Society Vidste du, at ligesom visse dyr her på Jorden, der er truede elementer, også? For eksempel, vi mister konstant helium, en gas, der trodser tyngdekraften og und -
 Brugereksperiment hos BESSY II—komplekse tesselleringer, ekstraordinære materialerDen nye byggeklods (venstre, rødt omrids) omfatter to modificerede startmolekyler forbundet med hinanden med et sølvatom (blåt). Dette fører til komplekse, semiregulære tesseller (højre, mikroskopbill
Brugereksperiment hos BESSY II—komplekse tesselleringer, ekstraordinære materialerDen nye byggeklods (venstre, rødt omrids) omfatter to modificerede startmolekyler forbundet med hinanden med et sølvatom (blåt). Dette fører til komplekse, semiregulære tesseller (højre, mikroskopbill -
 Tæmning af defekter i nanoporøse materialer for at udnytte dem godtÆndring af defekte nanoporøse materialer har unikke effekter på deres egenskaber. Swansea University-forskere søger at mestre denne metode til at lave nye materialer til at opfange CO2. Kredit:Swansea
Tæmning af defekter i nanoporøse materialer for at udnytte dem godtÆndring af defekte nanoporøse materialer har unikke effekter på deres egenskaber. Swansea University-forskere søger at mestre denne metode til at lave nye materialer til at opfange CO2. Kredit:Swansea -
 Forskere bruger neutroner til at forsøge at udvikle sig bedre, mindre omkostningskrævende tandrest…Neutronspredning ved ORNLs High Flux Isotope Reactor blev brugt til at studere effektiviteten af tandimplantater. Neutronbilleder illustrerer genoprettende materialer bundet til tandstrukturen via E
Forskere bruger neutroner til at forsøge at udvikle sig bedre, mindre omkostningskrævende tandrest…Neutronspredning ved ORNLs High Flux Isotope Reactor blev brugt til at studere effektiviteten af tandimplantater. Neutronbilleder illustrerer genoprettende materialer bundet til tandstrukturen via E
- Begge halvdele af NASAs Webb Telescope kommunikerer med succes
- Hvad Hollywood får rigtigt og forkert ved hacking
- Ultrakompakt metalens mikroskopi bryder FOV -begrænsninger
- Rapport bekræfter vindteknologiske fremskridt fortsætter med at presse vindenergipriserne ned
- Sådan fungerer økologisk mad
- Forskere afslører første kvantesimulering af 3D-topologisk stof med ultrakølede atomer


