Molekylær superlim viser løfte om platform til opdagelse af kræftlægemidler
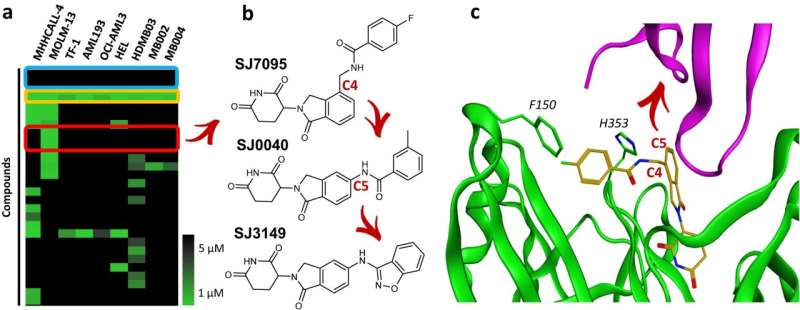
Forskere fra St. Jude Children's Research Hospital har offentliggjort deres arbejde med SJ3149, en forbindelse med bred aktivitet mod mange cancertyper, især akut myeloid leukæmi (AML). SJ3149 klæber til det kræftrelaterede protein kaseinkinase 1 alfa (CK1α), hvilket fører til dets ødelæggelse.
Værket er publiceret i tidsskriftet Nature Communications .
"Vi har lavet en molekylær superlim," sagde senior co-korresponderende forfatter Zoran Rankovic, Ph.D., St. Jude Department of Chemical Biology and Therapeutics. "SJ3149 er den første i klassens potente og selektive CK1α-nedbryder, der viser effektivitet i både in vitro og in vivo cancermodeller."
Molekylær lim virker ved at kapre cellens naturlige proteingenbrugsmekanisme. Den molekylære lim rekrutterer det målrettede protein til et enzym, der markerer det til ødelæggelse gennem en proces kaldet proteasomal nedbrydning. For mange kræftrelaterede proteiner, som ikke kan målrettes godt af konventionelle småmolekylehæmmere, kan molekylære lime være et levedygtigt terapeutisk alternativ. Dette førte til, at forskerne ved St. Jude udviklede et stort proprietært bibliotek af molekylære lime og screenede det mod en række kræftcellelinjer og fandt et første hit.
Når forskerne optimerede det identificerede hit, viste det resulterende SJ3149-molekyle højere styrke og mindre effekter uden for målet end lignende forbindelser. SJ3149 udviste lovende bred anti-cancer aktivitet selv for en molekylær lim, deraf betegnelsen "super-lim". Forbindelsen ser også ud til at have en profil, der ligner en klasse af godkendte kræftlægemidler, murine double minute 2 (MDM2)-hæmmere, hvilket yderligere indikerer, at det kan have klinisk nytte.
Platform til opdagelse af molekylær lim
Molekylær lim er en lovende brønd, hvorfra man kan finde nye terapier, fordi de kan målrette mod tidligere uhæmmelige proteiner. Det har imidlertid været en udfordring at finde og tilpasse disse molekyler til klinisk brug. At identificere og raffinere et sådant molekyle giver et bevis på, at St. Jude-tilgangen kan fremskynde denne opdagelsesproces.
"Vores arbejde giver en plan for at udføre lignende undersøgelser for andre mål," sagde medkorresponderende forfatter Marcus Fischer, Ph.D., St. Jude Department of Chemical Biology and Therapeutics. Forskerne opdagede forbindelsen, ændrede den gennem rationelt design og testede dens effektivitet. For at forstå, hvordan forbindelsen fungerede så godt, krystalliserede Fischers gruppe det store kompleks af det målrettede protein og SJ3149 bundet til cellens maskineri, der var ansvarlig for at mærke proteiner til nedbrydning, et protein ubiquitin-ligaseapparat.
"Vi kunne se, at skønheden ved denne forbindelse er, at den interagerer direkte med CK1α," forklarede Fischer. "SJ3149 når over og forbinder direkte CK1α til enzymet, der markerer det for det cellulære nedbrydningsmaskineri, hvilket giver en begrundelse for forbindelsens høje nedbrydningseffektivitet."
At forstå, hvordan sådanne forbindelser virker på atomniveau, kan bane vejen for det rationelle design af molekylære lime.
"Dette er et perfekt eksempel på at tage kemiske stoffer og skabe strukturelle og mekanistiske indsigter for at forstå effektivitet og cellulær aktivitet," sagde co-korresponderende forfatter Jeffery Klco, MD, Ph.D., St. Jude Department of Pathology, en læge-videnskabsmand med fokus på AML. "På dette stadium er det stadig kun en hovedforbindelse, men dette kan udvikle sig til en anden potentiel mulighed for behandling af forskellige pædiatriske kræftformer, hvilket er spændende."
Oprettelse af forbindelsen var en stor samarbejdsindsats. Arbejdet indebar design, syntetisering og screening af det molekylære limbibliotek, strukturstyret lægekemioptimering og test i patient-afledte cancerceller. Det var kun muligt gennem den kombinerede ekspertise fra Rankovic, Fischer og Klcos laboratorier, i samråd med interne og eksterne samarbejdspartnere. Fremgangsmåden kan nu bruges som grundlag for yderligere opdagelse.
"Kemisk biologi er trådt ind i et nyt paradigme med molekylære lime," sagde Rankovic. "Med denne undersøgelse har vi nu etableret en pipeline til at identificere nye lovende molekylære lime til kræftbehandlinger."
Flere oplysninger: Gisele Nishiguchi et al., Selektive CK1α-nedbrydere udøver antiproliferativ aktivitet mod en bred vifte af humane cancercellelinjer, Nature Communications (2024). DOI:10.1038/s41467-024-44698-1
Journaloplysninger: Nature Communications
Leveret af St. Jude Children's Research Hospital
 Varme artikler
Varme artikler
-
 Kemikere udvikler nyt materiale til adskillelse af kuldioxid fra industrielle affaldsgasserElektronmikroskopisk tværsnitsbillede af det nye hybridmateriale. Det var muligt at fremstille glaspladerne meget præcist og, afbrudt af afstandsstykker, at lægge dem oven på hinanden. Kredit:Martin R
Kemikere udvikler nyt materiale til adskillelse af kuldioxid fra industrielle affaldsgasserElektronmikroskopisk tværsnitsbillede af det nye hybridmateriale. Det var muligt at fremstille glaspladerne meget præcist og, afbrudt af afstandsstykker, at lægge dem oven på hinanden. Kredit:Martin R -
 Undersøgelse ændrer langvarige koncepter for celleafkodningBeregningsmodel af et makromolekylært kompleks. Kredit:NIDA IRP og Dr. Sergi Ferré Forskere ved National Institute on Drug Abuse (NIDA) Intramural Research Program (IRP) har afsløret beviser, der
Undersøgelse ændrer langvarige koncepter for celleafkodningBeregningsmodel af et makromolekylært kompleks. Kredit:NIDA IRP og Dr. Sergi Ferré Forskere ved National Institute on Drug Abuse (NIDA) Intramural Research Program (IRP) har afsløret beviser, der -
 Hvordan ioner samler vandmolekyler omkring demBochums forskerhold:Gerhard Schwaab, Martina Havenith og Federico Sebastiani (fra venstre). Kredit:RUB, Marquard Ladede partikler i vandige opløsninger er altid omgivet af en skal af vandmolekyler
Hvordan ioner samler vandmolekyler omkring demBochums forskerhold:Gerhard Schwaab, Martina Havenith og Federico Sebastiani (fra venstre). Kredit:RUB, Marquard Ladede partikler i vandige opløsninger er altid omgivet af en skal af vandmolekyler -
 Ledende papir kunne muliggøre fremtidig fleksibel elektronikForskere laver ledende papir ved at belægge det med en ionisk gel. Kredit:American Chemical Society Roll-up computerskærme og anden fleksibel elektronik kommer tættere på virkeligheden, efterhånde
Ledende papir kunne muliggøre fremtidig fleksibel elektronikForskere laver ledende papir ved at belægge det med en ionisk gel. Kredit:American Chemical Society Roll-up computerskærme og anden fleksibel elektronik kommer tættere på virkeligheden, efterhånde
- Pas på dig selv:selvovervågningsstrategien for at holde supermarkedshandlende ærlige
- Er det OK at tage sanddollar fra stranden?
- Cambodjaansk folkedrab dokumenteret i ofre bevaret tøj
- Hvordan pandemien skader olie- og gasindustrien
- UTA rumfartsingeniør undersøger muligheden for hypersonisk passager, fragtfly
- Sådan skrives en laboratorieprocedure ved hjælp af flowdiagrammetode


