En ny tilgang kan adressere antibiotikaresistens over for Mycobacterium abcessus
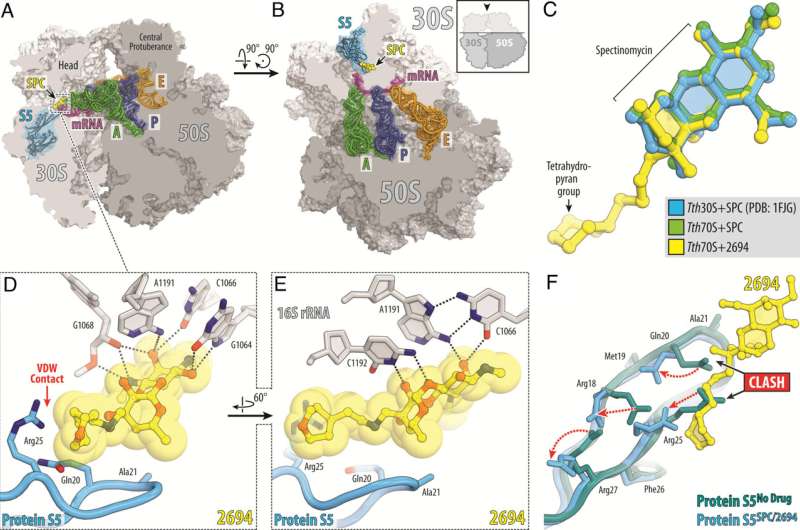
Forskere på St. Jude Children's Research Hospital er i gang med at tackle Mycobacterium abscessus (Mab) antibiotikaresistens. Dette naturligt antibiotika-resistente patogen bliver mere udbredt, hvilket understreger det presserende behov for nye terapeutiske midler. For at løse dette har forskerne designet nye versioner af lægemidlet spectinomycin, der overvinder efflux, den vigtigste mekanisme, der driver resistens. Værket er udgivet i Proceedings of the National Academy of Science .
Mab-infektioner findes i stigende grad i sundhedsvæsenet. Sådanne infektioner kan være farlige for patienter med kompromitteret lungefunktion, såsom i cystisk fibrose, eller som er immunologisk kompromitteret, såsom i børnekræft. Disse infektioner behandles med lange antibiotikakure og kan resultere i dårlige resultater.
Fremkomsten af Mab og andre lignende patogener udgør en voksende og dybt bekymrende trussel mod folkesundheden, fordi der er få effektive terapeutiske muligheder og en begrænset lægemiddeludviklingspipeline.
"Vi kemikere er i et kapløb mod patogenerne. Vi laver stærkere antibiotika, og patogenerne bliver mere resistente," siger den tilsvarende forfatter Richard Lee, Ph.D., St. Jude Department of Chemical Biology and Therapeutics.
Forskere ved St. Jude modificerede det naturligt forekommende antibiotikum spectinomycin for at skabe analoger, sammenlignelige, men strukturelt forskellige N-ethylen-bundne aminomethyl-spectinomyciner (eAmSPC'er). Disse syntetisk fremstillede eAmSPC'er er op til 64 gange mere potente mod Mab end standard spectinomycin.
"Ved at omstrukturere molekylet gennem strukturbaseret lægemiddeldesign har vi og vores samarbejdspartnere tilpasset antibiotikaen for at øge dens aktivitet," tilføjede Lee.
Overvinding af efflux for at lave et mere effektivt antibiotikum
Gennem deres arbejde afslørede forskerne den virkningsmekanisme, hvormed eAmSPC'er er mere effektive:de omgår efflux. Efflux er den proces, som celler bruger til at slippe af med et lægemiddel - forestil dig at pumpe vand ud af en oversvømmet kælder - og er en væsentlig mekanisme, hvorved celler bliver resistente over for terapi.
N-ethylenbindingsstrukturen af eAmSPC'erne spiller en kritisk rolle i, hvordan forbindelserne undgår efflux, hvilket tyder på, at længere bindinger ændrer, hvordan forbindelsen pumpes ud af cellen. Dette flytter i sidste ende balancen mod højere koncentrationer af eAmSPC i cellen og øger dermed den antimikrobielle effektivitet.
"I løbet af de sidste to årtier har vi set en massiv stigning i antallet af infektioner forårsaget af ikke-tuberkuløse mykobakterier som Mab," sagde co-first forfatter Gregory Phelps, PharmD, St. Jude Graduate School of Biomedical Sciences. "Vi havde et sted at starte med dette naturligt forekommende antibiotikum, som vi gennem modifikation har gjort meget mere effektivt mod dette klinisk relevante patogen."
Forskerne fandt også ud af, at eAmSPC'er fungerer godt sammen med forskellige klasser af antibiotika, der bruges til at behandle Mab og bevarer deres aktivitet mod andre mycobakterielle stammer. Dette arbejde viser, at eAmSPC'er bør undersøges og udvikles yderligere, fordi når spørgsmål om tolerabilitet og sikkerhed er behandlet, kan disse forbindelser blive næste generations terapeutika.
"Det er udfordrende at tiltrække medicinalvirksomheder til at udvikle nye antibiotika af flere økonomiske årsager," sagde Phelps. "Hvis vi kan booste lægemiddelpipelinen mod denne svære at behandle bakterier, kan vi potentielt gøre en forskel for patienter som dem, vi har her på St. Jude, som i stigende grad står over for begrænsede eller ingen terapeutiske muligheder."
Flere oplysninger: Gregory A. Phelps et al., Development of 2nd generation aminomethyl spectinomycins that overvinde native efflux in Mycobacterium abscessus, Proceedings of the National Academy of Sciences (2024). DOI:10.1073/pnas.2314101120
Journaloplysninger: Proceedings of the National Academy of Sciences
Leveret af St. Jude Children's Research Hospital
 Varme artikler
Varme artikler
-
 Overgangsmetalfrit bariumhydrid medierer dinitrogenfiksering og ammoniaksynteseOvergangsmetalfri dinitrogenfiksering medieret af bariumhydrid. Kredit:Guan Yeqin Ammoniak er afgørende for fremstillingen af kvælstofgødning. På grund af det høje energiforbrug ved industriel am
Overgangsmetalfrit bariumhydrid medierer dinitrogenfiksering og ammoniaksynteseOvergangsmetalfri dinitrogenfiksering medieret af bariumhydrid. Kredit:Guan Yeqin Ammoniak er afgørende for fremstillingen af kvælstofgødning. På grund af det høje energiforbrug ved industriel am -
 Forskere finder potente kemiske midler, der kan forhindre kræftmetastaserMaurizio Pellecchia fra UC Riverside i laboratoriet. Kredit:Carrie Rosema For nylig, et forskerhold ledet af Maurizio Pellecchia ved University of California, Riverside, opdaget en måde, hvorpå ke
Forskere finder potente kemiske midler, der kan forhindre kræftmetastaserMaurizio Pellecchia fra UC Riverside i laboratoriet. Kredit:Carrie Rosema For nylig, et forskerhold ledet af Maurizio Pellecchia ved University of California, Riverside, opdaget en måde, hvorpå ke -
 Forskere forvandler ikke-giftige rester til belægning, der modstår slid, plet og sollysEn stol påført lignin. Kredit:Fotoni Film &Communications På grund af den globale indsats for at opfylde bæredygtighedsstandarder, mange lande søger i øjeblikket at erstatte beton med træ i bygnin
Forskere forvandler ikke-giftige rester til belægning, der modstår slid, plet og sollysEn stol påført lignin. Kredit:Fotoni Film &Communications På grund af den globale indsats for at opfylde bæredygtighedsstandarder, mange lande søger i øjeblikket at erstatte beton med træ i bygnin -
 Startup skalerer kulstof-nanorørmembraner op for at lave kulstof-nul brændstoffer til mindre end f…Mattershift, en NYC-baseret startup med alumner fra MIT og Yale har opnået et gennembrud i fremstillingen af carbon nanorør (CNT) membraner i stor skala. Startupet udvikler teknologiens evne til at
Startup skalerer kulstof-nanorørmembraner op for at lave kulstof-nul brændstoffer til mindre end f…Mattershift, en NYC-baseret startup med alumner fra MIT og Yale har opnået et gennembrud i fremstillingen af carbon nanorør (CNT) membraner i stor skala. Startupet udvikler teknologiens evne til at
- 6th Grade Electricity Project Ideas
- Ny rapport undersøger videnskaben om interventioner for at redde koralrev
- Ny strategi muliggør successiv spaltning og funktionalisering af C–C-bindinger i alkoholer
- Nysgerrig hvidhaj leger med kameraet
- Månen har nøglen til at forbedre satellitbilleder af Jorden
- On-chip optisk filter behandler en lang række lysbølgelængder


