Forsker karakteriserer enzymer med N-N-bindinger til antibakterielle applikationer
Byggestenene til nye lægemidler, der hjælper med at bekæmpe bakterier, der er resistente over for eksempelvis kendte antibiotika, skal være så omkostningseffektive og miljøvenlige som muligt. Enzymer er ideelle til dette formål. For eksempel kan de producere eller kombinere forskellige komponenter af aktive stoffer.
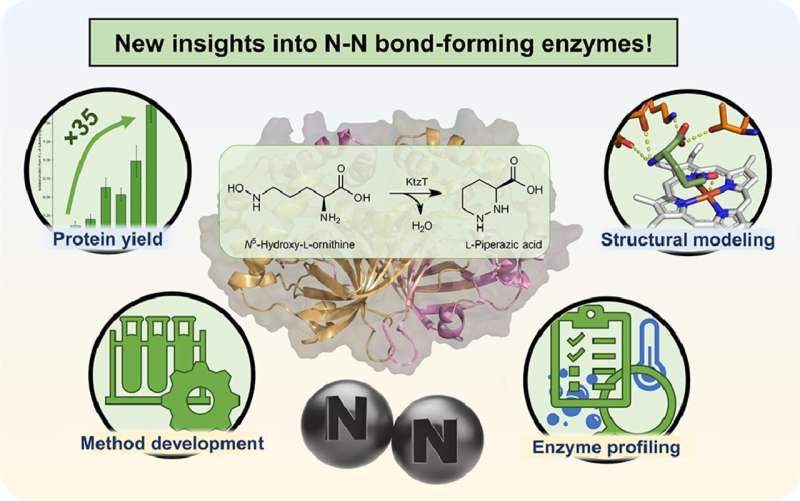
Simon Schröder karakteriserede i sin kandidatafhandling i Microbial Biotechnology group ved Ruhr University Bochum et enzym mere detaljeret, der er i stand til at danne en ønsket nitrogen-nitrogenbinding i molekyler. Han fandt også andre enzymer, der kan gøre dette. Værket er publiceret i tidsskriftet Molecular Catalysis .
Byggesten begrænser designet af nye aktive stoffer
Forskere er i konstant konkurrence med skadelige mikroorganismer, der udvikler antibiotikaresistens. I jagten på nye aktive stoffer forsøger de traditionelt at isolere mikroorganismer fra naturen, der udviser antibiotisk adfærd. De identificerer derefter de ansvarlige stoffer og undersøger deres funktion. I dag suppleres denne proces med computerstøttede metoder, der gør det muligt at designe skræddersyede nye molekyler, der har specifikke effekter på organismer og deres metaboliske processer.
"Men designet og produktionen af sådanne kunstige forbindelser er ofte begrænset af, hvilke precursor-molekyler eller byggesten der er tilgængelige til deres produktion," forklarer Schröder. Ideelt set bør deres produktionsproces være økonomisk og økologisk, for eksempel ved at bruge mikroorganismer eller deres katalytiske enzymer. Udvidelsen af det modulære system af tilgængelige molekyler til at producere nye lægemidler er derfor tilsvarende vigtig og interessant.

Gør den ønskede binding lettere tilgængelig
"Vi arbejder på produktionen af en bestemt type af sådanne molekyler," forklarer Schröder. I 2017 blev der isoleret et enzym, der kan danne nitrogen-nitrogen-bindingen i molekyler, som sjældent findes i naturen. Man ved dog stadig meget lidt om dette enzym med det systematiske navn "KtzT":Hvordan virker det? I hvilke forbindelser kan det danne denne binding? Er det egnet til at producere farmaceutisk relevante molekyler?
"I første omgang var vi i stand til at forbedre produktionen og isoleringen af dette enzym i laboratoriet med en faktor på 35," rapporterer Schröder. "Dette gjorde os i stand til at karakterisere KtzT, dvs. at identificere dets optimale reaktionsbetingelser:Ved hvilken temperatur, hvilken pH-værdi fungerer det bedst, og hvor stabilt er det under en lang række forhold?"
Forskerholdet har også fundet og isoleret KtzT-lignende enzymer og vist, at de også er i stand til at katalysere reaktionen. "Vi var også i stand til at implementere en flertrinsreaktion med flere enzymer, hvilket gjorde nitrogen-nitrogen-bindingen endnu nemmere at få adgang til," siger Schröder.
Han brugte blandt andet bioinformatiske metoder til at udvikle en strukturel model af enzymet, som gør det muligt at opstille hypoteser om reaktionsmekanismen og specifikt modificere enzymet, så det også kan danne nitrogen-nitrogen-bindingen i andre forbindelser.
Flere oplysninger: Simon Schröder et al., Forbedring af biokatalytisk N-N-bindingsdannelse med den aktinobakterielle piperazatsyntase KtzT, Molecular Catalysis (2023). DOI:10.1016/j.mcat.2023.113733
Leveret af Ruhr-Universitaet-Bochum
 Varme artikler
Varme artikler
-
 Mekanisk vejrtrækning i smarte vinduerForskere undersøger måder at forhindre en polymers mekaniske vejrtrækning, ” en effekt, der får lagene i et smart vindue til at delaminere. Kredit:Purdue University billede/Xiaokang Wang Smarte vi
Mekanisk vejrtrækning i smarte vinduerForskere undersøger måder at forhindre en polymers mekaniske vejrtrækning, ” en effekt, der får lagene i et smart vindue til at delaminere. Kredit:Purdue University billede/Xiaokang Wang Smarte vi -
 Aniondoping på højt niveau mod hurtig ladningsoverførselskinetik til kondensatorerKredit:CC0 Public Domain Forskerholdet af prof. Xiaobo Ji og associeret prof. Guoqiang Zou har foreslået en genial ilt-vacancy (OV) ingeniørstrategi for at realisere højt indhold af anionisk dopin
Aniondoping på højt niveau mod hurtig ladningsoverførselskinetik til kondensatorerKredit:CC0 Public Domain Forskerholdet af prof. Xiaobo Ji og associeret prof. Guoqiang Zou har foreslået en genial ilt-vacancy (OV) ingeniørstrategi for at realisere højt indhold af anionisk dopin -
 RNA grundlæggende byggesten produceret biokatalytisk for første gangGraz-forskerne er de første i verden til at demonstrere YeiN, et enzym, der er en egnet biokatalysator til fremstilling af C-nukleosider, de grundlæggende byggesten i RNA. Kredit:Lunghammer - TU Graz
RNA grundlæggende byggesten produceret biokatalytisk for første gangGraz-forskerne er de første i verden til at demonstrere YeiN, et enzym, der er en egnet biokatalysator til fremstilling af C-nukleosider, de grundlæggende byggesten i RNA. Kredit:Lunghammer - TU Graz -
 Forskere skaber smart stål, 30% stærkereDjalal Mirzayev. Kredit:SUSU Forskere fra South Ural State University arbejder på at producere en innovativ, superlys, og superstærk slags stål kaldet bainit. Dette nye materiale har potentielle a
Forskere skaber smart stål, 30% stærkereDjalal Mirzayev. Kredit:SUSU Forskere fra South Ural State University arbejder på at producere en innovativ, superlys, og superstærk slags stål kaldet bainit. Dette nye materiale har potentielle a
- Sådan laver du en Bubble Gum Science Project
- At finde falske fingeraftryk
- Forskning viser, hvordan man kan reducere omkostningerne ved moderne investeringsstrategier
- Dyb læring kan hjælpe med at forudsige, hvornår folk har brug for forlystelser
- Hvordan påvirker træer vejret?
- Den nysgerrige hændelse af sværm og sprites om natten


