Strukturelt redigerbart proksimalt cofaktor-lignende modul hjælper med at konstruere kunstig dual-center peroxygenase
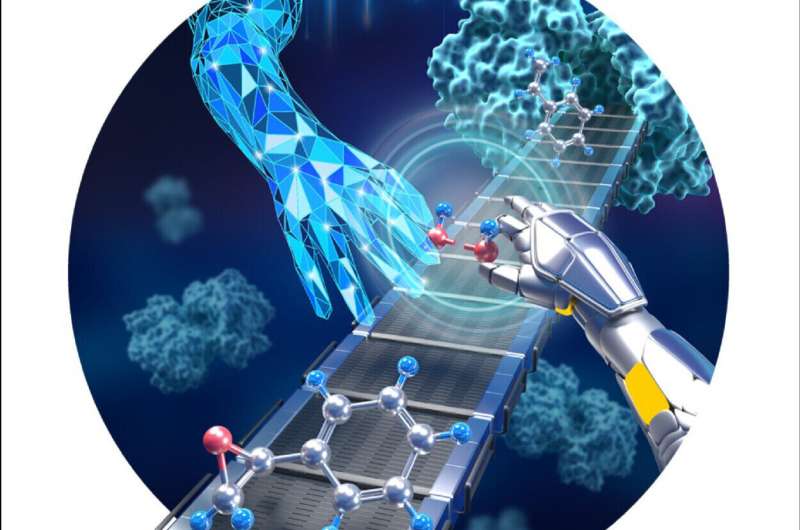
Cytokrom P450 monooxygenaser er vidt involveret i syntesen og metabolismen af endogene og eksogene stoffer i levende organismer. Den katalytiske effektivitet af cytochrom P450 monooxygenase er afhængig af coenzymet NAD(P)H og reducerende chaperonproteiner.
Strategien baseret på dual-functional small molecules (DFSM'er) kan omdanne P450 monooxygenase til peroxygenase, hvilket undgår at bruge det dyre coenzym og komplicere chaperoneproteiner. Der kræves dog overskydende DFSM'er på grund af deres lave bindingsaffinitet for P450, hvilket begrænser dets praktiske anvendelse.
For at løse dette problem har forskere fra Qingdao Institute of Bioenergy and Bioprocess Technology (QIBEBT) fra det kinesiske videnskabsakademi (CAS) udviklet et strukturelt redigerbart proksimalt kofaktor-lignende modul til at konstruere en kunstig dual-center peroxygenase.
Undersøgelsen blev offentliggjort i Angewandte Chemie International Edition den 27. oktober.
Forskerne konstruerede en kunstig dual-center peroxygenase ved at forankre en redigerbar organisk cofaktor til den proksimale position af hæm-centret af P450BM3 som et co-katalytisk center. Co-krystalstrukturen af P450BM3 i kompleks med den nye kunstige cofaktor afslørede klart en prækatalytisk tilstand, hvor cofaktoren deltog i H2 O2 aktivering, hvilket letter peroxygenaseaktivitet.
Sammenlignet med tidligere DFSM'er kunne de nye kunstige cofaktorer danne flere hydrogenbindinger og hydrofobe interaktioner med enzymet, hvilket tyder på en meget højere bindingsaffinitet. Endvidere blev dissociationskonstanterne (Kd) for nye cofaktorer nøjagtigt bestemt gennem titreringer. Kd-værdierne for nogle kunstige cofaktorer blev øget med tre størrelsesordener og sammenlignelige med bindingseffektiviteten af naturlige enzym-cofaktorer.
Enzymaktivitetsmålinger viste, at selv med tilsætning af kun en lille mængde nye kunstige cofaktorer (det dobbelte af enzymmængden), udviste systemet stadig høj katalytisk aktivitet for typiske P450 enzymoxidationsreaktioner såsom olefinepoxidation, hydroxylering af sp3-carboner og thioetheroxidation.
Desuden fandt forskerne, at forskellige katalytiske grupper, såsom imidazol-, pyridin- eller amingrupper, havde divergerende katalytisk aktivitet og selektivitet for substrater. Derfor vil forskellige typer af nye cofaktorer blive udvalgt baseret på egenskaberne af substrater for at opnå den optimale katalytiske effekt i fremtidige applikationer.
Flere oplysninger: Xiangquan Qin et al., Cover Picture:Anchoring a Structurally Editable Proximal Cofactor-like Module to Construct an Artificial Dual-center Peroxygenase, Angewandte Chemie International Edition (2023). DOI:10.1002/anie.202315458
Leveret af Chinese Academy of Sciences
 Varme artikler
Varme artikler
-
 Det perfekte shot af espresso hver gang med kemiForfining af espressobrygningsprocessen kan resultere i sparede penge og konsekvent velsmagende kaffe. Kredit:Charlie Litchfield, University of Oregon Den gennemsnitlige amerikaner drikker mere en
Det perfekte shot af espresso hver gang med kemiForfining af espressobrygningsprocessen kan resultere i sparede penge og konsekvent velsmagende kaffe. Kredit:Charlie Litchfield, University of Oregon Den gennemsnitlige amerikaner drikker mere en -
 Forskere udvikler kunstige kemiske receptorer til at hjælpe viral transduktion til T-celleteknikAnvendelse af kunstig kemisk receptor i CAR-konstrueret T-cellefremstilling og immunterapi af tumor. Kredit:CAI Lintao Konstrueret T-celle immunterapi, såsom kimærisk antigenreceptor T-celle (CAR-
Forskere udvikler kunstige kemiske receptorer til at hjælpe viral transduktion til T-celleteknikAnvendelse af kunstig kemisk receptor i CAR-konstrueret T-cellefremstilling og immunterapi af tumor. Kredit:CAI Lintao Konstrueret T-celle immunterapi, såsom kimærisk antigenreceptor T-celle (CAR- -
 Lab producerer simple fluorescerende overfladeaktive stofferRice University kemikere har produceret en række fluorescerende overfladeaktive stoffer til billeddannelse, biomedicinske og fremstillingsapplikationer. Kredit:Ashleigh Smith McWilliams/Rice Universit
Lab producerer simple fluorescerende overfladeaktive stofferRice University kemikere har produceret en række fluorescerende overfladeaktive stoffer til billeddannelse, biomedicinske og fremstillingsapplikationer. Kredit:Ashleigh Smith McWilliams/Rice Universit -
 Frigivelse af lægemidler fra et supramolekylært burForskere lykkes med at konstruere et supramolekylært bur og læsse det med farmaceutisk aktiv last. I vandig opløsning, ultralydsbølger åbner buret og frigiver lægemidlet. Kredit:HHU/Robin Küng Hvo
Frigivelse af lægemidler fra et supramolekylært burForskere lykkes med at konstruere et supramolekylært bur og læsse det med farmaceutisk aktiv last. I vandig opløsning, ultralydsbølger åbner buret og frigiver lægemidlet. Kredit:HHU/Robin Küng Hvo
- Kunne vi nogensinde udnytte kvantevakuumenergi?
- Forøgelse af afkastet på e-handels-retargeting-kampagner
- Lockdown ændrede irsk shopping- og madlavningsadfærd
- Planter kan forsvare sig selv ved at få larver til at dreje kannibal
- At finde NEMO:Fremtiden for gravitationsbølgeastronomi
- Hvor lang tid tager det at komme til Mars?


