Sådan opdeles et vandmolekyle
* Vand (H2O)
* Elektricitet
* To elektroder (metalplader)
* En beholder til at holde vandet
* Ledninger
Procedure
1. Fyld beholderen med vand.
2. Placer de to elektroder i vandet, og sørg for, at de ikke rører hinanden.
3. Forbind elektroderne til elkilden ved hjælp af ledningerne.
4. Tænd for elkilden.
Elektriciteten vil få vandmolekylerne til at opdeles i brint- og oxygenatomer. Brintatomerne vil samle sig ved den ene elektrode, mens oxygenatomerne vil samle sig ved den anden elektrode.
Sikkerhedsforanstaltninger
* Bær handsker og øjenværn.
* Rør ikke ved elektroderne, mens strømmen er tændt.
* Brug ikke denne procedure med andre væsker.
Forklaring
Når elektriciteten er tændt, udsættes vandmolekylerne for et stærkt elektrisk felt. Dette felt får vandmolekylerne til at bryde fra hinanden i brint- og oxygenatomer. Brintatomerne har en positiv ladning, mens iltatomerne har en negativ ladning. De positive og negative ladninger tiltrækkes af de modsat ladede elektroder. Brintatomerne tiltrækkes af den negative elektrode, mens oxygenatomerne tiltrækkes af den positive elektrode.
Applikationer
Processen med at spalte vand til brint og ilt kaldes elektrolyse. Elektrolyse bruges til at fremstille brintbrændstof, som er et rent brændende brændstof, der ikke udleder nogen forurenende stoffer. Elektrolyse bruges også til at producere ilt til industrielle og medicinske formål.
Sidste artikelMikrobielt svar på plastikforurening?
Næste artikelSamtykkeskemaer til forskning:Er de blevet forbedret på 25 år?
 Varme artikler
Varme artikler
-
 grafen, perovskites, og silicium – en ideel tandem til effektive solcellerDenne visualisering viser lag af grafen, der bruges til membraner. Kredit:University of Manchester Forskere ved universitetet i Rom Tor Vergata, det italienske teknologiske institut (IIT) og dets
grafen, perovskites, og silicium – en ideel tandem til effektive solcellerDenne visualisering viser lag af grafen, der bruges til membraner. Kredit:University of Manchester Forskere ved universitetet i Rom Tor Vergata, det italienske teknologiske institut (IIT) og dets -
 En kold opblødning sænker risikoen for salmonellavækst på spirede fødevarerKorn, frø og nødder, der er lagt i blød i koldt vand. Kredit:Joy Waite-Cusic, Oregon State University Iblødsætning af spirede fødevarer i koldt vand, snarere end den mere almindelige praksis med i
En kold opblødning sænker risikoen for salmonellavækst på spirede fødevarerKorn, frø og nødder, der er lagt i blød i koldt vand. Kredit:Joy Waite-Cusic, Oregon State University Iblødsætning af spirede fødevarer i koldt vand, snarere end den mere almindelige praksis med i -
 Første fleksible hukommelsesenhed, der bruger oxid ferroelektrisk materialeKredit:North Carolina State University For første gang, forskere har været i stand til at afsætte en ultratynd oxid ferroelektrisk film på et fleksibelt polymersubstrat. Forskerholdet brugte de fl
Første fleksible hukommelsesenhed, der bruger oxid ferroelektrisk materialeKredit:North Carolina State University For første gang, forskere har været i stand til at afsætte en ultratynd oxid ferroelektrisk film på et fleksibelt polymersubstrat. Forskerholdet brugte de fl -
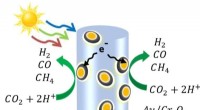 Soldrevet kemi bruger kuldioxid og vand til at fremstille råmaterialer til brændstoffer, kemikalie…Et diagram over halvledernannotrådene lavet af indium, gallium og nitrogen - dekoreret med guld- og kromoxidnanopartikler. Når lyset rammer nanotråden, frigør det elektroner og de positivt ladede hull
Soldrevet kemi bruger kuldioxid og vand til at fremstille råmaterialer til brændstoffer, kemikalie…Et diagram over halvledernannotrådene lavet af indium, gallium og nitrogen - dekoreret med guld- og kromoxidnanopartikler. Når lyset rammer nanotråden, frigør det elektroner og de positivt ladede hull
- FN opfordrer indtrængende til intens genopretning af naturen for at løse klima- og biodiversitetsk…
- Er afslutningen på 'partikelæra'-fysikken over os?
- Hvorfor solkoronaen er så meget varmere end solens overflade
- Sextortion shakedown-forsøg for Bitcoin-udbetalinger får fuld anatomi
- Eksperimentel analyse, computersimuleringer afslører, hvordan vævede stofkompositter deformeres af…
- 10 myter om lyn


