Besvarelse af mysteriet om, hvad atomer gør, når væsker og gasser mødes
Når en væske og en gas mødes, vil gasmolekylerne begynde at opløses i væsken. Denne proces kaldes opløsning. Opløsningshastigheden vil afhænge af flere faktorer, herunder væskens temperatur, tryk og overfladeareal.
Temperatur
Jo højere temperatur, jo flere gasmolekyler vil opløses i væsken. Det skyldes, at jo højere temperatur, jo mere energi har gasmolekylerne, og jo større sandsynlighed er der for, at de overvinder de kræfter, der holder dem sammen.
Tryk
Jo højere tryk, jo flere gasmolekyler vil opløses i væsken. Det skyldes, at jo højere tryk, jo flere gasmolekyler tvinges i kontakt med væsken, og jo større sandsynlighed er der for, at de opløses.
Væskens overfladeareal
Jo større overfladearealet af væsken er, jo flere gasmolekyler vil opløses i den. Dette skyldes, at jo større overfladearealet er, jo flere gasmolekyler er i kontakt med væsken, og jo større sandsynlighed er der for, at de opløses.
Hvad er virkningerne af opløsning?
Opløsningen af gasmolekyler i en væske kan have en række virkninger, herunder:
* Reduktion af væskens overfladespænding. Dette kan få væsken til at brede sig lettere og danne bobler.
* Ændring af væskens tæthed. Dette kan få væsken til at blive mere eller mindre tæt, alt efter om gasmolekylerne er tungere eller lettere end væskemolekylerne.
* Ændring af væskens viskositet. Dette kan gøre væsken mere eller mindre tyktflydende, alt efter om gasmolekylerne er større eller mindre end væskemolekylerne.
* Ændring af væskens farve. Dette kan ske, hvis gasmolekylerne absorberer eller reflekterer lys af en bestemt farve.
Ansøgninger om opløsning
Opløsningen af gasmolekyler i væsker har en række vigtige anvendelser, herunder:
* Kulsyreholdige drikkevarer. Kuldioxidgassen, der giver kulsyreholdige drikkevarer deres brusende smag, opløses i væsken under tryk.
* Scubadykning. Dykkere bruger trykluft, som er en blanding af ilt og nitrogengasser, til at trække vejret under vandet. Nitrogengassen opløses i dykkerens blod og frigives, når dykkeren kommer til overfladen.
* Brandslukning. Brandfolk bruger vand til at slukke brande. Vandet optager varme fra ilden, og dampen, der produceres, er med til at kvæle flammerne.
* Kemiske reaktioner. Mange kemiske reaktioner foregår i opløsning, hvor reaktanterne opløses i en væske. Dette gør det lettere for reaktanterne at komme i kontakt med hinanden og fremskynder reaktionen.
 Varme artikler
Varme artikler
-
 Ny form for interaktion opdaget i hydrogen-producerende enzymerKredit:Pixabay/CC0 Public Domain Hydrogenaser kan omdanne brint lige så effektivt som dyre platinkatalysatorer. For at gøre dem anvendelige til bioteknologiske anvendelser, forskere er ved at dech
Ny form for interaktion opdaget i hydrogen-producerende enzymerKredit:Pixabay/CC0 Public Domain Hydrogenaser kan omdanne brint lige så effektivt som dyre platinkatalysatorer. For at gøre dem anvendelige til bioteknologiske anvendelser, forskere er ved at dech -
 Programmering af pH:Ny teknik kan fremskynde DNA-synteseKredit:Pixabay/CC0 Public Domain pH - koncentrationen af protoner i en vandig opløsning - angiver, hvor sur opløsningen er. Det regulerer en bred vifte af naturlige og konstruerede kemiske proces
Programmering af pH:Ny teknik kan fremskynde DNA-synteseKredit:Pixabay/CC0 Public Domain pH - koncentrationen af protoner i en vandig opløsning - angiver, hvor sur opløsningen er. Det regulerer en bred vifte af naturlige og konstruerede kemiske proces -
 Forskere afslører mekanisme for dioxygenaktiveringKredit:Pixabay/CC0 Public Domain Metalloenzym kan koble dioxygenaktivering til substratfunktionalisering, som ofte udviser uovertruffen effektivitet, selv under omgivende forhold. Det menes, at m
Forskere afslører mekanisme for dioxygenaktiveringKredit:Pixabay/CC0 Public Domain Metalloenzym kan koble dioxygenaktivering til substratfunktionalisering, som ofte udviser uovertruffen effektivitet, selv under omgivende forhold. Det menes, at m -
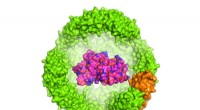 Forskere folder et protein i et proteinIllustration af et protein af interesse (POI) inde i en 24-underenhed Archeoglobus fulgidus ferritin exoshell, som er 12 nanometer i diameter (kun halvdelen af skallen er vist). Kredit:Dr. Chester L
Forskere folder et protein i et proteinIllustration af et protein af interesse (POI) inde i en 24-underenhed Archeoglobus fulgidus ferritin exoshell, som er 12 nanometer i diameter (kun halvdelen af skallen er vist). Kredit:Dr. Chester L
- Trumps administration beder Højesteret om at stoppe teenagers klimasag
- En ny katalysator til effektiv oxidation af inaktive alkaner
- Kvinders arbejdsstyrke transformation går tilbage til den store depression
- Forskere arbejder sammen med små virksomheder i NM for at teste nye respiratormaterialer
- Gør keramikfliseproduktion grønnere med genanvendt varme
- Forskere udvikler "net" nanodetektor


