Ændringer i tryk, mere end temperatur, påvirker i høj grad, hvor hurtigt væsker bliver til gas
Effekt af tryk:
* Lavere tryk, hurtigere fordampning: Når trykket omkring en væske falder, falder væskens kogepunkt også. Det betyder, at væskens molekyler kræver mindre energi for at overvinde de intermolekylære kræfter, der holder dem sammen og undslippe ind i gasfasen. Som et resultat sker fordampning hurtigere ved lavere tryk.
* Højere tryk, langsommere fordampning: Omvendt, når trykket stiger, stiger væskens kogepunkt. Det højere tryk giver mere modstand mod, at væskens molekyler bryder fri, hvilket forhindrer deres udslip i gasfasen. Derfor bremses fordampningen ved højere tryk.
Temperaturpåvirkning:
* Højere temperatur, hurtigere fordampning: Når temperaturen stiger, stiger den gennemsnitlige kinetiske energi af væskens molekyler også. Denne højere energi betyder, at molekylerne har en større tendens til at bevæge sig hurtigere og overvinde de intermolekylære kræfter, der holder dem sammen. Som følge heraf sker fordampningen hurtigere ved højere temperaturer.
* Lavere temperatur, langsommere fordampning: Omvendt, når temperaturen falder, falder den gennemsnitlige kinetiske energi af væskens molekyler. Den reducerede energi gør det mindre sandsynligt for molekylerne at bryde fri fra de intermolekylære kræfter, hvilket bremser fordampningsprocessen.
Så mens både tryk og temperatur spiller en rolle i væskers fordampningshastighed, har ændringer i tryk en stærkere indflydelse sammenlignet med ændringer i temperatur. Rent praktisk betyder det, at et fald i trykket omkring en væske kan øge dens fordampningshastighed dramatisk, selv ved samme temperatur, mens en forøgelse af trykket kan bremse fordampningen betydeligt.
 Varme artikler
Varme artikler
-
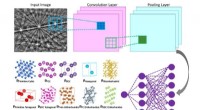 Maskinlæringsteknik fremskynder bestemmelse af krystalstrukturIllustration af den indre funktion af et konvolutionelt neuralt netværk, der beregner sandsynligheden for, at inputdiffraktionsmønsteret tilhører en given klasse (f.eks. Bravais-gitter eller rumgruppe
Maskinlæringsteknik fremskynder bestemmelse af krystalstrukturIllustration af den indre funktion af et konvolutionelt neuralt netværk, der beregner sandsynligheden for, at inputdiffraktionsmønsteret tilhører en given klasse (f.eks. Bravais-gitter eller rumgruppe -
 Aflytning af australske edderkoppers hemmeligheder unikt silkeKurve-spindderkoppen i sin naturlige form med sin unikke hummerpottespind og silke, som nu er blevet afsløret som enestående robust. Kredit:Professor Mark Elgar, University of Melbourne Et interna
Aflytning af australske edderkoppers hemmeligheder unikt silkeKurve-spindderkoppen i sin naturlige form med sin unikke hummerpottespind og silke, som nu er blevet afsløret som enestående robust. Kredit:Professor Mark Elgar, University of Melbourne Et interna -
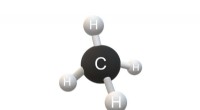 Tandemkatalyse forbedrer selektiv oxidation af metan til oxygenaterMetans struktur. Kredit:Christinelmiller/Wikimedia Commons, CC BY-SA 4.0 Selektiv oxidation af methan (CH4 ) til værditilvækstkemikalier med både høj katalytisk aktivitet og selektivitet under mild
Tandemkatalyse forbedrer selektiv oxidation af metan til oxygenaterMetans struktur. Kredit:Christinelmiller/Wikimedia Commons, CC BY-SA 4.0 Selektiv oxidation af methan (CH4 ) til værditilvækstkemikalier med både høj katalytisk aktivitet og selektivitet under mild -
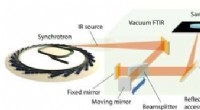 Undersøgelse af de komplekse dielektriske egenskaber af metal-organiske rammer (MOF'er)Figur 1:Den eksperimentelle opsætning til måling af bredbånds-IR-reflektiviteten af polykrystallinske MOF-pellets. De opnåede højopløsningsreflektivitetsdata blev efterfølgende brugt til at bestemme
Undersøgelse af de komplekse dielektriske egenskaber af metal-organiske rammer (MOF'er)Figur 1:Den eksperimentelle opsætning til måling af bredbånds-IR-reflektiviteten af polykrystallinske MOF-pellets. De opnåede højopløsningsreflektivitetsdata blev efterfølgende brugt til at bestemme
- Nyt Neliota-projekt registrerer glimt fra månepåvirkninger
- Instagram -test for at skjule likes, der spreder sig til USA
- Verdens skove optager i stigende grad mere kulstof
- Samsung rival OnePlus debuterer billigere Android-telefoner til 5G-videofans og -spillere
- Selvdrevne papirbaserede SPED'er kan føre til nye medicinsk-diagnostiske værktøjer
- Meldug vs. Skimmelsvamp:Hvad er forskellen?


