Hvilken farve vil en opløsning have ved ækvivalenspunktet for titreringen?
Farven på en opløsning ved ækvivalenspunktet afhænger af den anvendte indikator. En indikator er et stof, der ændrer farve over et bestemt pH-område. pH-området, over hvilket en indikator skifter farve, kaldes endepunktsområdet.
Ækvivalenspunktet er ikke altid på samme pH som slutpunktet. Dette skyldes, at pH-værdien af en opløsning afhænger af koncentrationen af både syrer og baser til stede. For de fleste titreringer er ækvivalenspunktet dog tæt på endepunktet.
Ved ækvivalenspunktet vil opløsningens pH være 7,0, hvis der anvendes en neutral indikator. Dette skyldes, at en neutral indikator skifter farve ved pH 7,0. Hvis der anvendes en sur indikator, vil opløsningens pH være mindre end 7,0 ved ækvivalenspunktet. Hvis der anvendes en basisindikator, vil opløsningens pH være større end 7,0 ved ækvivalenspunktet.
Her er en tabel, der opsummerer farven på en opløsning ved ækvivalenspunktet for forskellige typer indikatorer:
| Indikatortype | Farve ved ækvivalenspunkt |
|---|---|
| Neutral indikator | Grøn |
| Syrlig indikator | Rød |
| Grundlæggende indikator | Gul |
Sidste artikelHvad er varme inkluderet i ligningen for en endoterm reaktion?
Næste artikelHvor kommer det kemiske symbol for helium fra?
 Varme artikler
Varme artikler
-
 Forskere skaber stærke, hurtig, vandtæt klæbemiddelEn katalysator (for at få klæbemidlet til at holde hurtigt) og en tværbinder (for at gøre hold stærk) er anbragt i en lille mikrokapsel, der ligner en æggeskal, der går i stykker og frigiver tilsætnin
Forskere skaber stærke, hurtig, vandtæt klæbemiddelEn katalysator (for at få klæbemidlet til at holde hurtigt) og en tværbinder (for at gøre hold stærk) er anbragt i en lille mikrokapsel, der ligner en æggeskal, der går i stykker og frigiver tilsætnin -
 Forskere udvikler 3D-printet geléHydrogelmaterialet kommer fra tangpartikler af forskellig størrelse. Kredit:Orlin Velev, NC State University 3D-printbare geler med forbedrede og meget kontrollerede egenskaber kan skabes ved at f
Forskere udvikler 3D-printet geléHydrogelmaterialet kommer fra tangpartikler af forskellig størrelse. Kredit:Orlin Velev, NC State University 3D-printbare geler med forbedrede og meget kontrollerede egenskaber kan skabes ved at f -
 Forstå overfladekemien af SARS-CoV-2Farvelagt scanningselektronmikrofotografi af en celle (blå) stærkt inficeret med SARS-CoV-2-viruspartikler (rød), isoleret fra en patientprøve. Billede taget på NIAID Integrated Research Facility (IRF
Forstå overfladekemien af SARS-CoV-2Farvelagt scanningselektronmikrofotografi af en celle (blå) stærkt inficeret med SARS-CoV-2-viruspartikler (rød), isoleret fra en patientprøve. Billede taget på NIAID Integrated Research Facility (IRF -
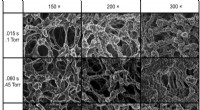 Forskere rapporterer om tosidede Janus-membranapplikationerDisse er overflade-SEM-billeder af Janus-membranfronter dyrket med 150, 200 og 300 cyklusser ved .015, 06 og 0,15 sekunder eksponeringer. En generel tendens til hurtigere nukleering og efterfølgende b
Forskere rapporterer om tosidede Janus-membranapplikationerDisse er overflade-SEM-billeder af Janus-membranfronter dyrket med 150, 200 og 300 cyklusser ved .015, 06 og 0,15 sekunder eksponeringer. En generel tendens til hurtigere nukleering og efterfølgende b


