Hvis en forbindelse har en empirisk formel på CH og masse 26 gram, hvad er den molekylære formel?
For at finde multiplumet dividerer vi den faktiske masse med molmassen af den empiriske formel:
$$\frac{Faktisk \space Mass}{Molar \space Masse \space af \space Empirisk \space Formel}=\frac{26g}{13 g/mol}=2$$
Det betyder, at molekylformlen skal være en dimer af den empiriske formel med dobbelt så mange atomer. Derfor er molekylformlen C2H2.
 Varme artikler
Varme artikler
-
 Kemiske forbindelser i fødevarer kan hæmme et centralt SARS-CoV-2-enzymKemiske forbindelser i muscadinedruer hæmmer effektivt en vigtig SARS-CoV-2-protease. Kredit:De-Yu Xie, NC State University Kemiske forbindelser i fødevarer eller drikkevarer som grøn te, muscadin
Kemiske forbindelser i fødevarer kan hæmme et centralt SARS-CoV-2-enzymKemiske forbindelser i muscadinedruer hæmmer effektivt en vigtig SARS-CoV-2-protease. Kredit:De-Yu Xie, NC State University Kemiske forbindelser i fødevarer eller drikkevarer som grøn te, muscadin -
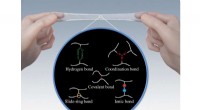 Elastomerer udvikler stærkere bindingsbindingerForskellige former for bindinger kan forbinde elastomerkæder sammen, ændre hvordan materialet opfører sig. Kredit:Yukikazu Takeoka Elastomerer er de bløde, elastiske materialer, som geler og gummi
Elastomerer udvikler stærkere bindingsbindingerForskellige former for bindinger kan forbinde elastomerkæder sammen, ændre hvordan materialet opfører sig. Kredit:Yukikazu Takeoka Elastomerer er de bløde, elastiske materialer, som geler og gummi -
 Forbedret metode til fremstilling af forgrenede polymererGrafisk abstrakt. Kredit:Chem (2022). DOI:10.1016/j.chempr.2022.02.022 Forgrenede polymerer, polymerer, der ligner små trægrene, har et betydeligt potentiale for vandfiltrering, det biomedicinske o
Forbedret metode til fremstilling af forgrenede polymererGrafisk abstrakt. Kredit:Chem (2022). DOI:10.1016/j.chempr.2022.02.022 Forgrenede polymerer, polymerer, der ligner små trægrene, har et betydeligt potentiale for vandfiltrering, det biomedicinske o -
 Strontiumtitanats nye egenskaber er vigtige for elektronikforskningEPR-spektre for de (001)-orienterede enkeltkrystalprøver med form som en stang og en plade af STO:Fe3+ ved T =300 K (a) og af en plade af STO:Mn4+ ved T =150 K (b) . Orienteringerne af prøverne i forh
Strontiumtitanats nye egenskaber er vigtige for elektronikforskningEPR-spektre for de (001)-orienterede enkeltkrystalprøver med form som en stang og en plade af STO:Fe3+ ved T =300 K (a) og af en plade af STO:Mn4+ ved T =150 K (b) . Orienteringerne af prøverne i forh
- Forskelle mellem kvadratiske og lineære ligninger
- Sådan ændrer du blandede numre til hele nummer
- Hvad gør et pattedyr til et pattedyr? Vores rygsøjle, siger videnskabsmænd
- Ny teknik lader forskere skabe modstandsfrie elektronkanaler
- Hvilke faktorer påvirker omkostningerne ved solpaneler?
- Satellitdata finder top i en daglig lyncyklus


