Hvorfor har ethen forskellige kemiske egenskaber end decan og hexan?
1. Umættethed:Ethen er et umættet carbonhydrid på grund af carbon-carbon dobbeltbindingen. Decan og hexan er på den anden side mættede carbonhydrider, hvilket betyder, at de kun indeholder carbon-carbon enkeltbindinger. Tilstedeværelsen af dobbeltbindingen i ethen gør den mere reaktiv over for forskellige kemiske reaktioner.
2. Additionsreaktioner:Ethen gennemgår let additionsreaktioner, hvor andre molekyler eller atomer adderer hen over carbon-carbon dobbeltbindingen. Dette er en karakteristisk egenskab for alkener (forbindelser indeholdende en carbon-carbon dobbeltbinding). Decan og hexan, som er alkaner, har ikke dobbeltbindinger og deltager derfor ikke i additionsreaktioner.
Nogle almindelige additionsreaktioner af ethen omfatter:
- Hydrogenering:Ethen reagerer med brintgas (H2) i nærværelse af en katalysator (såsom platin eller palladium) for at danne ethan (C2H6).
- Halogenering:Ethen reagerer med halogener (såsom klor eller brom) og danner dihalogenalkaner. For eksempel reagerer ethen med klorgas (Cl2) og danner 1,2-dichlorethan (C2H4Cl2).
- Hydrering:Ethen reagerer med vand (H2O) i nærværelse af en syrekatalysator (såsom svovlsyre) for at danne ethanol (C2H5OH).
3. Polymerisering:Ethen har evnen til at gennemgå polymerisering, som er en proces, hvor flere ethenmolekyler kombineres for at danne lange kæder af gentagne enheder. Denne proces, kendt som ethylenpolymerisation, er afgørende i produktionen af forskellige plasttyper, såsom polyethylen (PE) og polyvinylchlorid (PVC). Decan og hexan, som er alkaner, gennemgår ikke polymerisationsreaktioner.
4. Forbrænding:Ethen, decan og hexan gennemgår alle forbrændingsreaktioner med oxygen (O2) for at producere kuldioxid (CO2) og vand (H2O). Men på grund af tilstedeværelsen af dobbeltbindingen har ethen et højere energiindhold sammenlignet med decan og hexan. Det betyder, at ethen brænder med en varmere og mere lysende flamme.
Sammenfattende adskiller tilstedeværelsen af carbon-carbon-dobbeltbindingen i ethen dets kemiske egenskaber fra dekan og hexan. Ethens reaktivitet gør det muligt for det at gennemgå additionsreaktioner, polymerisation og forbrænding anderledes end alkaner som decan og hexan. Disse forskelle er afgørende for at bestemme deres anvendelser i forskellige industrier, herunder petrokemikalier, plastik og brændstof.
 Varme artikler
Varme artikler
-
 Træbaseret teknologi skaber elektricitet fra varmeKredit:University of Maryland Et team af forskere, der ledes af University of Maryland, har skabt en varme-til-elektricitetsenhed, der kører på ioner, og som en dag kan udnytte kroppens varme for
Træbaseret teknologi skaber elektricitet fra varmeKredit:University of Maryland Et team af forskere, der ledes af University of Maryland, har skabt en varme-til-elektricitetsenhed, der kører på ioner, og som en dag kan udnytte kroppens varme for -
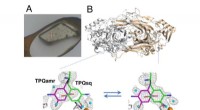 Enzymer ufrosset eventyr:I krystalproteintermodynamikIkke-kryokølet krystal monteret ved hjælp af HAG-metoden (A) og temperaturafhængig ligevægtsændring af katalytiske mellemprodukter i kobberaminoxidase (B). Kredit:Osaka University Enzymer - biokat
Enzymer ufrosset eventyr:I krystalproteintermodynamikIkke-kryokølet krystal monteret ved hjælp af HAG-metoden (A) og temperaturafhængig ligevægtsændring af katalytiske mellemprodukter i kobberaminoxidase (B). Kredit:Osaka University Enzymer - biokat -
 Retsmedicinsk analysemetode for læbestiftsspor udvikletKredit:Unsplash/CC0 Public Domain Retsmedicinere finder en ny måde at identificere mærker af læbestift på et gerningssted uden at fjerne beviser fra tasken. Ved hjælp af en teknik kaldet Raman -s
Retsmedicinsk analysemetode for læbestiftsspor udvikletKredit:Unsplash/CC0 Public Domain Retsmedicinere finder en ny måde at identificere mærker af læbestift på et gerningssted uden at fjerne beviser fra tasken. Ved hjælp af en teknik kaldet Raman -s -
 Hvordan bakterier opbygger et enzym, der ødelægger klimaskiftende lattergasKredit:CC0 Public Domain Ny forskning fra University of East Anglia afslører, hvordan jordbakterier bygger det eneste kendte enzym til ødelæggelse af den kraftige globale opvarmning og ozonnedbryd
Hvordan bakterier opbygger et enzym, der ødelægger klimaskiftende lattergasKredit:CC0 Public Domain Ny forskning fra University of East Anglia afslører, hvordan jordbakterier bygger det eneste kendte enzym til ødelæggelse af den kraftige globale opvarmning og ozonnedbryd
- Alle liv har betydning:Indonesien redder tsunami-strandede skildpadder
- Luftkvaliteten kan være bedre for aktive pendlere end chauffører, viser forskning
- Sådan beregnes en vinkel fra to sider
- Hvorfor Connecticut er en model til at reducere raceforskelle i trafikstop - og hvorfor andre stater…
- Er der en kemisk formel for ammoniak og klor?
- Sådan bruges Chisanbop til at tælle


