Enzymer ufrosset eventyr:I krystalproteintermodynamik
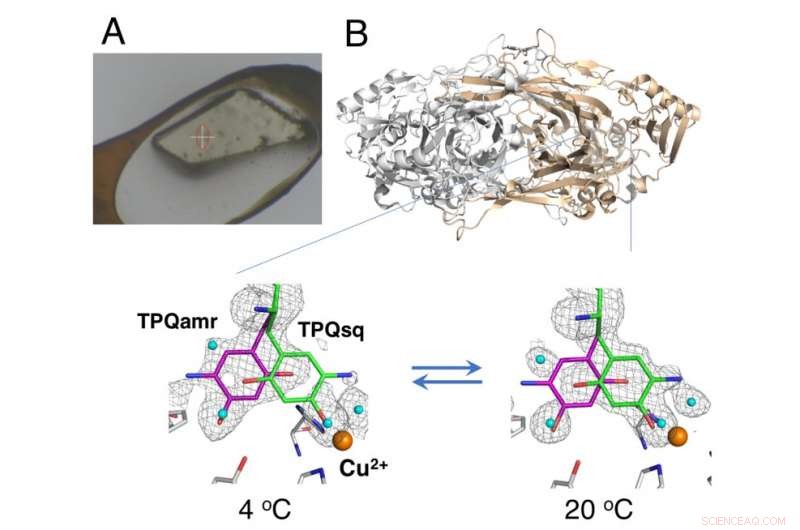
Ikke-kryokølet krystal monteret ved hjælp af HAG-metoden (A) og temperaturafhængig ligevægtsændring af katalytiske mellemprodukter i kobberaminoxidase (B). Kredit:Osaka University
Enzymer - biokatalysatorer lavet af proteiner - er enormt vigtige molekyler, der katalyserer reaktioner og processer i levende organismer. Igangværende arbejde med at forstå deres strukturer og reaktionsmekanismer er derfor afgørende for at udvide vores viden og bidrage til videnskabelige og medicinske fremskridt.
Røntgenkrystallografi - hvor proteinkrystaller udsættes for en røntgenstråle, resulterer i specifikke diffraktionsmønstre, der kan analyseres - er den mest udbredte teknik til proteinstrukturbestemmelse. Dataindsamling i røntgenkrystallografi involverer sædvanligvis at placere krystaller under en kryogen gasstrøm ved 100 K; imidlertid, de kryogene forhold tillader generelt ikke termodynamisk analyse af de konformationelle ændringer i proteinkrystallerne. Nu, forskere fra Osaka University, Osaka Medical College, Japan Synchrotron Radiation Research Institute (JASRI), og RIKEN har rapporteret detaljerne om strukturelle ændringer under den katalytiske reaktion af en kobberaminoxidase ved anvendelse af en ikke-kryogen teknik. Deres resultater blev offentliggjort i PNAS .
Undersøgelsen brugte en "humid air and glue-coating (HAG)"-metode udviklet af JASRI på synkrotronanlægget SPring-8. I stedet for kryogen afkøling, de ufrosne proteinkrystaller blev overtrukket med en vandopløselig polymer og anbragt under en strøm af fugtig nitrogengas med præcist kontrolleret temperatur. Dette gjorde det muligt for den næsten nøgne krystal at forblive stabil nok til, at holdet kunne vurdere ligevægten mellem de strukturelt adskilte konformationer af redox-kofaktoren (en væsentlig komponent i den katalytiske reaktion) ved en bestemt temperatur.
"Som et resultat af den præcise temperaturkontrol, vi var i stand til at opnå, vi demonstrerede den første succesfulde i krystallo termodynamisk analyse af arbejdsenzymet, " siger undersøgelsens korresponderende forfatter Toshihide Okajima. "Termodynamiske analyser baseret på krystalmålinger giver en tættere repræsentation af de strukturelle ændringer end data opnået fra løsningsstudier, og er derfor mere værdifulde for vores forståelse."
Ud over, de opnåede termodynamiske parametre viste en adfærd, der svarede til den i cytosol i celler. Det menes derfor, at HAG-forholdene kan give en brugbar model for fysiologiske forhold. Forskellige andre krystallografiske teknikker er blevet rapporteret til anvendelse ved omgivelsestemperatur; imidlertid, de kræver specialiserede røntgenfri lasere.
"Ved at bruge den temperaturkontrollerede HAG-metode, vi har vist, at det er muligt at opnå konformationel information ved hjælp af en standard røntgenstråle, " Okajima forklarer. "Vi håber, at tilgængeligheden af teknikken og dens muligheder for at levere termodynamisk information vil gøre den til en vigtig tilføjelse til nuværende krystallografiske tilgange."
 Varme artikler
Varme artikler
-
 Sådan forudsiger man produkter i kemiske reaktionerKemistuderende har typisk problemer med at forudsige produkterne fra kemiske reaktioner. Med praksis bliver processen imidlertid gradvis lettere. Det første trin --- identificering af den involvered
Sådan forudsiger man produkter i kemiske reaktionerKemistuderende har typisk problemer med at forudsige produkterne fra kemiske reaktioner. Med praksis bliver processen imidlertid gradvis lettere. Det første trin --- identificering af den involvered -
 Brug af en porøs porphyrin til at genvinde ædle metaller fra elektronisk affaldPorøs porfyrinpolymer (COP-180) kan udvinde guld fra et computerkredsløb og producere rene guldklumper. Kredit:Yeongran Hong Et internationalt hold af forskere har brugt en porøs porphyrin til at
Brug af en porøs porphyrin til at genvinde ædle metaller fra elektronisk affaldPorøs porfyrinpolymer (COP-180) kan udvinde guld fra et computerkredsløb og producere rene guldklumper. Kredit:Yeongran Hong Et internationalt hold af forskere har brugt en porøs porphyrin til at -
 Forskningsgruppen bruger supercomputing til at målrette de mest lovende lægemiddelkandidater ud fr…En skematisk oversigt over BRD4 -proteinet bundet til et af 16 lægemidler baseret på det samme tetrahydroquinolin -stillads (fremhævet i magenta). Regioner, der er kemisk modificeret mellem de lægemid
Forskningsgruppen bruger supercomputing til at målrette de mest lovende lægemiddelkandidater ud fr…En skematisk oversigt over BRD4 -proteinet bundet til et af 16 lægemidler baseret på det samme tetrahydroquinolin -stillads (fremhævet i magenta). Regioner, der er kemisk modificeret mellem de lægemid -
 Enzym kan få en nøglerolle i lægemiddeldesign til brystkræft og hjernesygdomKredit:Københavns Universitet I de seneste år, forskere har fokuseret på enzymet TLK2, mistænkes for at spille en hovedrolle i flere sygdomme. En ny undersøgelse foretaget på Københavns Universite
Enzym kan få en nøglerolle i lægemiddeldesign til brystkræft og hjernesygdomKredit:Københavns Universitet I de seneste år, forskere har fokuseret på enzymet TLK2, mistænkes for at spille en hovedrolle i flere sygdomme. En ny undersøgelse foretaget på Københavns Universite
- 10 videnskabelige spørgsmål, du virkelig bør vide, hvordan du svarer
- Forskere finder potentiel anvendelse for genbrugsplast i beton
- Forskere skaber proteinpulver med bare mikrober,
- Eftermonterede byer tvinger beboerne til at leve med planlægningssvigt
- Ultralydsvibrationer tvinger en polymer til at være en halvleder
- Plastmikrofibre fundet for første gang i afføring af vilde dyr, fra sydamerikanske pels sæler


