Hvad er den empiriske formel for zinkchlorid?
Antag, at vi har en prøve af zinkchlorid og bestem masserne af Zn og Cl til stede. Lad os sige, at vi finder ud af, at prøven indeholder 1 gram Zn og 1,33 gram Cl.
Konverter masserne til mol ved hjælp af deres respektive atommasser:
Mol Zn =1 g / 65,38 g/mol (atommasse af Zn) ≈ 0,0153 mol
Mol Cl =1,33 g / 35,45 g/mol (atommasse af Cl) ≈ 0,0375 mol
Divider mol af hvert grundstof med det mindste antal mol for at opnå det enkleste hele talforhold:
0,0153 mol Zn / 0,0153 mol ≈ 1
0,0375 mol Cl / 0,0153 mol ≈ 2,45
For at få hele tal skal du gange forholdet med en passende faktor (i dette tilfælde 2):
2 × 1 ≈ 2
2 × 2,45 ≈ 5
Den empiriske formel for zinkchlorid er derfor ZnCl2. Denne formel angiver, at for hvert 1 zinkatom er der 2 chloratomer i forbindelsen.
Sidste artikelHvad er et passende forhold mellem klor og vand?
Næste artikelHvad er den empiriske formel for metan?
 Varme artikler
Varme artikler
-
 Forskere søger svamp for at belyse kræftKandidatstuderende Ananya Sengupta (l) og adjunkt i kemi og biokemi James Frederich fandt ud af, at et produkt afledt af en svamp kunne kaste lys over cellulære interaktioner fremtrædende i cancer. Kr
Forskere søger svamp for at belyse kræftKandidatstuderende Ananya Sengupta (l) og adjunkt i kemi og biokemi James Frederich fandt ud af, at et produkt afledt af en svamp kunne kaste lys over cellulære interaktioner fremtrædende i cancer. Kr -
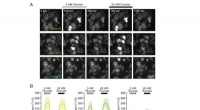 Grønne fluorescerende proteinbaserede glukoseindikatorer til overvågning af glukosemetabolisme i r…A:Billeder af HeLa -celler, der udtrykker Green Glifon50, Grøn Glifon600 og Grøn Glifon4000. Skalaen repræsenterer 20 μm. B:Ændringer i fluorescensintensitet (FI) i HeLa -celler, der udtrykker de tre
Grønne fluorescerende proteinbaserede glukoseindikatorer til overvågning af glukosemetabolisme i r…A:Billeder af HeLa -celler, der udtrykker Green Glifon50, Grøn Glifon600 og Grøn Glifon4000. Skalaen repræsenterer 20 μm. B:Ændringer i fluorescensintensitet (FI) i HeLa -celler, der udtrykker de tre -
 Kontrol af kunstige cilia med magnetfelter og lysFotografi af en række magnetiske cilia foldet og holdt i spidsen af pincet. Kredit:Jessica A.-C. Liu Forskere fra North Carolina State University og Elon University har lavet kunstige cilia, ell
Kontrol af kunstige cilia med magnetfelter og lysFotografi af en række magnetiske cilia foldet og holdt i spidsen af pincet. Kredit:Jessica A.-C. Liu Forskere fra North Carolina State University og Elon University har lavet kunstige cilia, ell -
 Rh-ensemble-katalysator til effektiv behandling af biludstødningProfessor Hyunjoo Lee og ph.d.-kandidat Hojin Jeong. Kredit:Korea Advanced Institute of Science and Technology (KAIST) Et KAIST-forskerhold har udviklet en fuldt dispergeret Rh-ensemble-katalysato
Rh-ensemble-katalysator til effektiv behandling af biludstødningProfessor Hyunjoo Lee og ph.d.-kandidat Hojin Jeong. Kredit:Korea Advanced Institute of Science and Technology (KAIST) Et KAIST-forskerhold har udviklet en fuldt dispergeret Rh-ensemble-katalysato
- Hvad er radial spaltning?
- Hvordan man laver en Styrofoam Kalium Atom til School
- Forskere foreslår, at mekanisk tryk udløser en nøglebegivenhed i HIV-infektion
- Kemikalier anvendt i kemi i gymnasiet
- Din reaktion på billeder af Leonardo DiCaprio, dyr kunne låse din næste smartphone op
- Gamma-stråleteleskoper afslører en højenergifælde i vores galaksecenter


