Kan kemiske reaktioner afgive elektrisk energi?
Galvaniske celler består af to halvceller, der hver indeholder en elektrode (anode og katode) og en elektrolytopløsning. Når to forskellige metaller/elektroder forbindes gennem en ekstern ledning og placeres i separate beholdere af elektrolytopløsningerne, sker der en kemisk reaktion, og elektroner overføres fra den ene elektrode til den anden. Bevægelsen af elektroner skaber en elektrisk strøm, og cellen genererer et elektrisk potentiale eller spænding.
De kemiske reaktioner, der finder sted i halvcellerne, involverer oxidation (tab af elektroner) ved anoden og reduktion (forstærkning af elektroner) ved katoden. Den overordnede kemiske reaktion fører til frigivelse af elektrisk energi, som kan udnyttes til forskellige applikationer som strømforsyning til enheder eller opladning af batterier.
Eksempler på galvaniske celler omfatter batterier som bly-syre-batteriet, der bruges i biler, eller lithium-ion-batterier i elektroniske enheder. I disse batterier producerer kemiske reaktioner mellem elektroderne, såsom bly- og blyoxid eller lithium- og metaloxider, en elektrisk strøm og genererer den nødvendige spænding til at betjene enhederne.
Sidste artikelHvor mange hydrogener og oxygener har ribose?
Næste artikelHvad er en forbindelse med vand knyttet?
 Varme artikler
Varme artikler
-
 Koordineringspolymerer med op til 99,99% antibakteriel effektivitetKredit:RUDN University En kemiker ved RUDN University har sammen med sine kolleger fra Portugal udviklet to typer belægninger baseret på nye koordineringspolymerer med sølv. Begge forbindelser ble
Koordineringspolymerer med op til 99,99% antibakteriel effektivitetKredit:RUDN University En kemiker ved RUDN University har sammen med sine kolleger fra Portugal udviklet to typer belægninger baseret på nye koordineringspolymerer med sølv. Begge forbindelser ble -
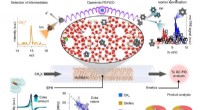 Reaktionsindsigt hjælper med at lave bæredygtige flydende brændstofferTilgang til kortlægning af den katalyserede produktion og udvikling af kulbrinter. Skematisk over multi-teknik strategien brugt i denne undersøgelse til at optrevle væksten af kulstofkæden, fra dann
Reaktionsindsigt hjælper med at lave bæredygtige flydende brændstofferTilgang til kortlægning af den katalyserede produktion og udvikling af kulbrinter. Skematisk over multi-teknik strategien brugt i denne undersøgelse til at optrevle væksten af kulstofkæden, fra dann -
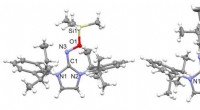 Fange radikale molekyler, før de forsvinderKrystalstruktur af to af de fire radikale kationer syntetiseret i undersøgelsen. Kernen (oxim) er stabiliseret med en ringformet struktur (NHC), og resten af molekylet viser let ekspansion. Den mole
Fange radikale molekyler, før de forsvinderKrystalstruktur af to af de fire radikale kationer syntetiseret i undersøgelsen. Kernen (oxim) er stabiliseret med en ringformet struktur (NHC), og resten af molekylet viser let ekspansion. Den mole -
 Vandopdeling til konvertering af solenergiPt-modificerede BaTaO2N fotokatalysatorer. Kredit:Citeret fra Wang, Z., Luo, Y., Hisatomi, T. et al. Sekventiel cokatalysatordekoration på BaTaO2N mod højaktiv Z-skema vandspaltning. Nat Commun 12, 10
Vandopdeling til konvertering af solenergiPt-modificerede BaTaO2N fotokatalysatorer. Kredit:Citeret fra Wang, Z., Luo, Y., Hisatomi, T. et al. Sekventiel cokatalysatordekoration på BaTaO2N mod højaktiv Z-skema vandspaltning. Nat Commun 12, 10
- Klimapåvirkede ændringer i blomstring, frugt påvirker også fuglens overflod, aktiviteter
- Kortlægning af de motorveje, som de første australiere rejste
- Kompositmetalskum tager varmen, rykke tættere på udbredte applikationer
- Chimpanser anvender insekter på sår, et potentielt tilfælde af medicinbrug?
- Simuleringer løser en 20 år gammel gåde om, hvorfor tåger omkring massive stjerner ikke forsvind…
- Sådan konverteres AMU til muldvarp


