Hvad er forskellen mellem to kerner i en kovalent binding?
- Debitering: I en kovalent binding bevarer kernerne i begge atomer deres oprindelige ladning. De bliver ikke positivt eller negativt ladede ioner, som de ville i en ionbinding.
- Elektrondeling: I en kovalent binding deler kernerne et eller flere elektronpar mellem sig. Dette delte elektronpar er det, der holder atomerne sammen og danner den kovalente binding.
- Molekylær orbital dannelse: Når atomer danner kovalente bindinger, overlapper deres atomare orbitaler for at skabe molekylære orbitaler. Disse molekylære orbitaler er de områder omkring kernerne, hvor de delte elektroner findes.
- Elektrondensitet: I en kovalent binding er elektrontætheden koncentreret i området mellem kernerne, hvor de delte elektronpar er placeret.
Samlet set ligger den vigtigste forskel mellem to kerner i en kovalent binding i deling af elektroner mellem dem. Denne elektrondeling resulterer i dannelsen af en stabil binding, der holder atomerne sammen og definerer deres molekylære struktur.
Sidste artikelEr Hcl en blandingsforbindelse eller grundstof?
Næste artikelKan du bruge peroxid på en forbrænding til at rense den?
 Varme artikler
Varme artikler
-
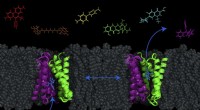 Ny model afslører muligheden for at pumpe antibiotika ind i bakterierEt transportørprotein - kaldet EmrE, vist i lilla og grønt -- i cellemembranen af E. coli kan bakterier skiftes mellem to konformationer for at pumpe molekyler (såsom antibakterielle lægemidler) ud
Ny model afslører muligheden for at pumpe antibiotika ind i bakterierEt transportørprotein - kaldet EmrE, vist i lilla og grønt -- i cellemembranen af E. coli kan bakterier skiftes mellem to konformationer for at pumpe molekyler (såsom antibakterielle lægemidler) ud -
 Simple entropier for komplicerede molekylerGrafisk abstrakt. Kredit:Beregning af absolutte molekylære entropier og varmekapaciteter gjort enkel, Kemisk Videnskab (2021). DOI:10.1039/D1SC00621E Kemikere fra universitetet i Bonn udviklede
Simple entropier for komplicerede molekylerGrafisk abstrakt. Kredit:Beregning af absolutte molekylære entropier og varmekapaciteter gjort enkel, Kemisk Videnskab (2021). DOI:10.1039/D1SC00621E Kemikere fra universitetet i Bonn udviklede -
 Undersøgelse beskriver ny måde at generere insulinproducerende celler påKredit:CC0 Public Domain Forskere ved Karolinska Institutet i Sverige viser, hvordan et molekyle, som de har identificeret, stimulerer dannelsen af nye insulinproducerende celler i zebrafisk og p
Undersøgelse beskriver ny måde at generere insulinproducerende celler påKredit:CC0 Public Domain Forskere ved Karolinska Institutet i Sverige viser, hvordan et molekyle, som de har identificeret, stimulerer dannelsen af nye insulinproducerende celler i zebrafisk og p -
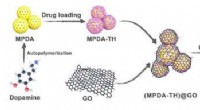 Cellulose nanofibril-baseret indkapslingsstruktur til at kontrollere lægemiddelfrigivelseDesignet af MPDA@GO/CNF-indkapslingsstrukturen og applikationen til kontrolleret lægemiddelfrigivelse. Kredit:LIU Yingying Intelligente hydrogeler med flere funktioner såsom vedvarende lægemiddelf
Cellulose nanofibril-baseret indkapslingsstruktur til at kontrollere lægemiddelfrigivelseDesignet af MPDA@GO/CNF-indkapslingsstrukturen og applikationen til kontrolleret lægemiddelfrigivelse. Kredit:LIU Yingying Intelligente hydrogeler med flere funktioner såsom vedvarende lægemiddelf
- To uger mindre sne i gennemsnit registreret i bjergområder siden 1982
- Gennembrudssensor til at hjælpe mennesker med bipolar lidelse med at overvåge litiumniveauer
- Stjerners død vil spille en ond flipper med rytmiske planeter
- 5G trådløs race varmer op
- NASA ser på Tropical Storm Kirks Caribien nedbør
- For tredje gang i denne uge sætter Jorden en uofficiel varmerekord. Hvad er der bag de store tal?


