Hvordan varierer atomnumrene af grundstoffer inden for hver gruppe 1 2 og 13 til 18 periodiske system?
- Atomnumrene for grundstoffer i gruppe 1 og 2 stiger fra top til bund.
- Antallet af valenselektroner (ydre skalelektroner) stiger med én for hvert element, der bevæger sig ned i gruppen.
- Atomradierne øges også ned ad grupperne, da de ekstra elektronskaller øger afstanden fra kernen.
Gruppe 13 til 18 (borfamilie til ædelgasser)
- Atomtallet for grundstoffer i gruppe 13 til 18 stiger fra venstre mod højre i løbet af perioden.
- Antallet af valenselektroner stiger med én for hvert grundstof, der bevæger sig hen over perioden.
- Atomradiuserne falder generelt hen over perioden, da de ekstra protoner i kernen trækker elektronerne tættere på.
Undtagelser:
- Ædelgassernes atomradius (Gruppe 18) er større end de grundstoffer, der går forud for dem i deres respektive perioder på grund af deres komplette valenselektronskaller, hvilket fører til svagere interatomiske kræfter.
- Der er små uregelmæssigheder i atomradiustendenserne for nogle overgangsmetaller på grund af deres komplekse elektroniske strukturer.
Sidste artikelEr opløsningen af natriumnitrit sur eller basisk?
Næste artikelJo stærkere metalliske bindinger har de mere hvad?
 Varme artikler
Varme artikler
-
 Detaljeret billede afslører, hvordan tandemaljen er stærk nok til at holde livet udPIC -kortlægning, som måler biominerale krystalorienteringer og tildeler forskellige farver til forskellige rotationsvinkler, afslører, at krystallerne i tandemaljen ikke er perfekt justeret. Kredit:P
Detaljeret billede afslører, hvordan tandemaljen er stærk nok til at holde livet udPIC -kortlægning, som måler biominerale krystalorienteringer og tildeler forskellige farver til forskellige rotationsvinkler, afslører, at krystallerne i tandemaljen ikke er perfekt justeret. Kredit:P -
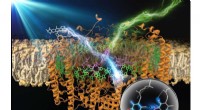 Forskere forbedrer et fotosyntetisk enzym ved at tilføje fluoroforerUdvidelse af enzymets bånd af lysbølgelængder, der kan høstes, er en vigtig forbedring i betragtning af sollysets ekstremt lave energitæthed. Kredit:Takehisa Dewa fra Nagoya Institute of Technology
Forskere forbedrer et fotosyntetisk enzym ved at tilføje fluoroforerUdvidelse af enzymets bånd af lysbølgelængder, der kan høstes, er en vigtig forbedring i betragtning af sollysets ekstremt lave energitæthed. Kredit:Takehisa Dewa fra Nagoya Institute of Technology -
 Fremgangsmåder til vækst af store proteinkrystaller til neutronproteinkrystallografiFlowkrystallisationskammer. Kredit:SINE2020 Evnen til at dyrke store proteinkrystaller er den største enkeltstående flaskehals, der begrænser brugen af neutronproteinkrystallografi i strukturel
Fremgangsmåder til vækst af store proteinkrystaller til neutronproteinkrystallografiFlowkrystallisationskammer. Kredit:SINE2020 Evnen til at dyrke store proteinkrystaller er den største enkeltstående flaskehals, der begrænser brugen af neutronproteinkrystallografi i strukturel -
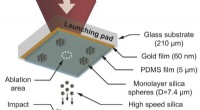 Forskere viser, at materialer styrkes af sig selv, når de påvirkes med meget høj hastighedSkematisk illustration af den laser-inducerede mikropartikel-påvirkningstest Kredit:U.S. Army Research Laboratory Forskere fra hæren og MIT avancerede en unik eksperimentel enhed for bedre at test
Forskere viser, at materialer styrkes af sig selv, når de påvirkes med meget høj hastighedSkematisk illustration af den laser-inducerede mikropartikel-påvirkningstest Kredit:U.S. Army Research Laboratory Forskere fra hæren og MIT avancerede en unik eksperimentel enhed for bedre at test
- Forskere løser et grundlæggende problem med at overføre kvanteinformation
- Sådan beregner du Epicenter
- Sådan beregnes området for en uregelmæssig Trapezoid
- Ediacara Biota blomstrede i bakterierige marine habitater
- Anisotrope plasmoner i kvasi-metalliske 2-D materialer
- Forskere afbilder ladningsfordelingen inden for et enkelt molekyle for første gang


