Bestem pH i en 5 M HA opløsning ved 25 grader Ka 7,1 x 10-4?
$$pH =pK_a + log\frac{[A^-]}{[HA]}$$
hvor pKa er den negative logaritme af syredissociationskonstanten (Ka), [A-] er koncentrationen af den konjugatbase, og [HA] er koncentrationen af den svage syre.
Ved at indsætte de givne værdier i ligningen får vi:
$$pH =-log(7.1 \time 10^{-4}) + log\frac{0}{5}$$
Da koncentrationen af den konjugerede base [A-] initialt er 0, bliver log-leddet -∞
$$pH =3,15 - ∞$$
Derfor kan pH-værdien af 5 M HA-opløsningen ved 25 grader Celsius ikke bestemmes ved hjælp af Henderson-Hasselbalch-ligningen, da koncentrationen af konjugatbasen er nul, hvilket resulterer i en udefineret pH-værdi.
Sidste artikelHvad er den empiriske formel for 22 procent kulstof 4,6 brint 73,4 brom?
Næste artikelHvad er oxidationstilstanden for CO32?
 Varme artikler
Varme artikler
-
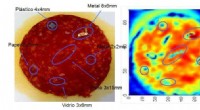 Design af sensorer til at detektere fremmedlegemer i fødevarerBillede opnået med denne teknologi, hvor der kan ses, på et stykke pølse, plast, metaller og splinter af glas i forskellige størrelser og former. Kredit:Elhuyar Fundazioa Forskere ved NUP/UPNA-Pub
Design af sensorer til at detektere fremmedlegemer i fødevarerBillede opnået med denne teknologi, hvor der kan ses, på et stykke pølse, plast, metaller og splinter af glas i forskellige størrelser og former. Kredit:Elhuyar Fundazioa Forskere ved NUP/UPNA-Pub -
 Brug af maskinlæring til at identificere lovende polymermembranerKredit:Unsplash/CC0 Public Domain Polymermembraner er almindeligt anvendt i industrien til adskillelse af gasser som CO2 fra røggas og metan fra naturgas. I løbet af flere årtier har forskere stude
Brug af maskinlæring til at identificere lovende polymermembranerKredit:Unsplash/CC0 Public Domain Polymermembraner er almindeligt anvendt i industrien til adskillelse af gasser som CO2 fra røggas og metan fra naturgas. I løbet af flere årtier har forskere stude -
 Nyt katalysatormateriale producerer rigeligt billigt brintKredit:CC0 Public Domain QUT-kemiforskere har opdaget billigere og mere effektive materialer til fremstilling af brint til lagring af vedvarende energi, der kan erstatte nuværende vandspaltningska
Nyt katalysatormateriale producerer rigeligt billigt brintKredit:CC0 Public Domain QUT-kemiforskere har opdaget billigere og mere effektive materialer til fremstilling af brint til lagring af vedvarende energi, der kan erstatte nuværende vandspaltningska -
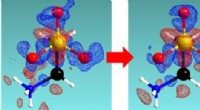 Statistisk inferens for at efterligne den meget erfarne krystallografs driftsmådePræcision af krystallografisk observation blev forbedret fra venstre mod højre ved hjælp af måledesign baseret på den foreslåede metode. Forskelle fra faktiske til sfæriske elektrontætheder er beskrev
Statistisk inferens for at efterligne den meget erfarne krystallografs driftsmådePræcision af krystallografisk observation blev forbedret fra venstre mod højre ved hjælp af måledesign baseret på den foreslåede metode. Forskelle fra faktiske til sfæriske elektrontætheder er beskrev
- Hvor kommer ingredienserne til din chokolade, smartphone og tøj fra?
- Den turbulente æra udløste et spring i menneskelig adfærd, tilpasningsevne 320, 000 år siden
- Gravitationsbølge sparker det sorte hul ud af den galaktiske kerne
- Udfordringer til at udvikle bæredygtigt dyrebrug i det vestlige Pennsylvania
- Hvor mange slags delfiner er der?
- Fortnite lærer de forkerte lektioner


