Hvorfor eksisterer N2 som gas, mens P er et fast stof?
Som et resultat af den mindre atomare størrelse af nitrogen har det større ioniseringsentalpi end fosfor. Nitrogen har således en større tendens til at tilbageholde elektroner. Nitrogen-nitrogen-bindinger er meget stærkere end fosfor-fosfor-bindinger. På grund af dette eksisterer fosfor som P4-molekyler, mens nitrogen eksisterer som N2-molekyler. På grund af tilstedeværelsen af flere bindinger mellem nitrogenatomer er N2-molekylet ret inert. Som følge heraf eksisterer N2 som en gas ved stuetemperatur. På den anden side danner fosfor bindinger med sig selv, hvilket resulterer i dannelsen af P4, som er et polymert molekyle og derfor har et højt smeltepunkt og eksisterer som et fast stof ved stuetemperatur.
Sidste artikelHvilken af følgende er en elektrolytopløsning?
Næste artikelHvilke sikkerhedsregler ved brug af syre eller
 Varme artikler
Varme artikler
-
 Massespektrometriteknik hjælper med at identificere forfalskede Robert Burns-manuskripterRobert Burns af Alexander Nasmyth (1758-1840). Kredit:Public Domain Et team af forskere ved University of Glasgow har udviklet en massespektrometriteknik til at identificere forfalskede manuskript
Massespektrometriteknik hjælper med at identificere forfalskede Robert Burns-manuskripterRobert Burns af Alexander Nasmyth (1758-1840). Kredit:Public Domain Et team af forskere ved University of Glasgow har udviklet en massespektrometriteknik til at identificere forfalskede manuskript -
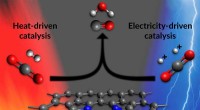 Hvordan en enkelt katalysator kan begynde at omdanne kuldioxid til brændstof på to måderDenne illustration viser et af de aktive steder i en ny katalysator, der fremskynder det første trin i fremstilling af brændstoffer og nyttige kemikalier fra kuldioxid. De aktive steder består af nikk
Hvordan en enkelt katalysator kan begynde at omdanne kuldioxid til brændstof på to måderDenne illustration viser et af de aktive steder i en ny katalysator, der fremskynder det første trin i fremstilling af brændstoffer og nyttige kemikalier fra kuldioxid. De aktive steder består af nikk -
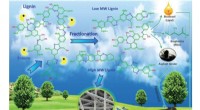 Bjerge af affald kan føre til ny amerikansk fremstilling, jobEt affaldsmateriale fra papir- og papirmasseindustrien kunne snart laves til alt fra tennisketcher til biler, ifølge nye fund fra Texas A&M AgriLife Research -forskere. Kredit:Texas A&M AgriLife Resea
Bjerge af affald kan føre til ny amerikansk fremstilling, jobEt affaldsmateriale fra papir- og papirmasseindustrien kunne snart laves til alt fra tennisketcher til biler, ifølge nye fund fra Texas A&M AgriLife Research -forskere. Kredit:Texas A&M AgriLife Resea -
 Smart løsning til at opdage fordærvelse af skaldyrKredit:CC0 Public Domain Vigtigt, Flinders Universitys professor i akvakultur Jian Qin - der ledede undersøgelsen sammen med Flinders kollega professor Youhong Tang - siger, at denne enkle enhed k
Smart løsning til at opdage fordærvelse af skaldyrKredit:CC0 Public Domain Vigtigt, Flinders Universitys professor i akvakultur Jian Qin - der ledede undersøgelsen sammen med Flinders kollega professor Youhong Tang - siger, at denne enkle enhed k


