Hvordan dannes en kovalent binding mellem to atomer?
1. Atomorbitaler: Hvert atom, der er involveret i bindingen, har sine egne atomorbitaler, som er områder omkring kernen, hvor der er størst sandsynlighed for, at elektroner findes.
2. Elektronparring: Når to atomer nærmer sig hinanden, overlapper deres atomare orbitaler, hvilket tillader deres elektroner at interagere.
3. Elektrondeling: Elektronerne i de overlappende orbitaler kan parre sig og blive delt mellem de to atomer. Denne deling af elektroner fører til dannelsen af en kovalent binding.
4. Electron Cloud: De delte elektroner er ikke længere begrænset til de atomare orbitaler af individuelle atomer, men optager i stedet en molekylær orbital, som er et område med høj elektrontæthed, der eksisterer mellem kernerne i de bundne atomer.
5. Obligationsdannelse: Tiltrækningen mellem de positivt ladede kerner og de negativt ladede delte elektroner holder de to atomer sammen, hvilket resulterer i dannelsen af en stabil kovalent binding.
6. Elektronkonfiguration: Ved at dele elektroner opnår hvert atom en mere stabil elektronkonfiguration, der typisk ligner elektronkonfigurationen af en ædelgas.
Overvej for eksempel dannelsen af en kovalent binding mellem to hydrogenatomer (H-H). Hvert brintatom har en elektron i sin 1s atomare orbital. Når de to brintatomer kommer tæt på hinanden, overlapper deres 1s orbitaler. De to elektroner fra 1s orbitaler parrer sig og bliver delt mellem de to brintatomer og danner en kovalent binding. Det delte elektronpar er placeret i den molekylære orbital dannet mellem de to brintkerner, hvilket resulterer i det stabile H-H molekyle.
Denne grundlæggende forklaring kan udvides til mere komplekse kovalente bindinger, der involverer flere elektronpar og flere atomare orbitaler. Deling af elektroner og overlapning af atomare orbitaler er grundlæggende begreber i forståelsen af dannelsen af kovalente bindinger og stabiliteten af molekyler.
Sidste artikelHvordan beregner man kobber og zink i en øre?
Næste artikelHvilken effekt har temperaturen på reaktionshastigheden?
 Varme artikler
Varme artikler
-
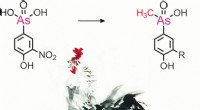 Methylerede phenylarseniske metabolitter identificeret i kyllingeleverKosttilskud, der indeholder arsen, har været forbudt i EU siden 1999 og i Nordamerika siden 2013. I mange lande tilsættes de stadig til fjerkræfoder for at forhindre parasitinfektion og fremme vægtøgn
Methylerede phenylarseniske metabolitter identificeret i kyllingeleverKosttilskud, der indeholder arsen, har været forbudt i EU siden 1999 og i Nordamerika siden 2013. I mange lande tilsættes de stadig til fjerkræfoder for at forhindre parasitinfektion og fremme vægtøgn -
 Nye teorier og materialer hjælper overgangen til ren energiIllustration, der fremhæver de tre former for katalyse, der er beskrevet i det nye studie. Kredit:Jason Drees / The Biodesign Institute ved Arizona State University For hver dag der går, den mørke
Nye teorier og materialer hjælper overgangen til ren energiIllustration, der fremhæver de tre former for katalyse, der er beskrevet i det nye studie. Kredit:Jason Drees / The Biodesign Institute ved Arizona State University For hver dag der går, den mørke -
 Molekylær twist gør én katalysator anvendelig til tre brintapplikationerVed at dreje den røde blå, og grønne positioner af et molekyle som at dreje på rattet i en bil, et enkelt molekyle udviklet af forskere i Japan kan omdannes til tre typer katalysatorer til brændselsce
Molekylær twist gør én katalysator anvendelig til tre brintapplikationerVed at dreje den røde blå, og grønne positioner af et molekyle som at dreje på rattet i en bil, et enkelt molekyle udviklet af forskere i Japan kan omdannes til tre typer katalysatorer til brændselsce -
 Video:Hvordan hårfarve virkerKredit:The American Chemical Society Uanset om du har brug for en forklædning for at løbe fra loven eller bare prøver at efterligne *NSYNC-tidens frostede tip, du kan få brug for noget kemisk assi
Video:Hvordan hårfarve virkerKredit:The American Chemical Society Uanset om du har brug for en forklædning for at løbe fra loven eller bare prøver at efterligne *NSYNC-tidens frostede tip, du kan få brug for noget kemisk assi
- NASA sender 2 flere helikoptere til Mars for at hjælpe med at returnere sten
- Studiet giver indsigt i, hvordan alger suger kuldioxid fra luften
- Forskere opdager supernova, der overstråler alle andre
- Hvordan en Sharknado ville fungere
- Buler i vulkaner kunne bruges til at forudsige udbrud
- Hvem skal bestemme, hvad der tæller som 'uorden'?


