Hvordan ligner hydrogennatrium og rubidium hinanden?
1. Alkalimetaller:
- Hydrogen, natrium og rubidium er alle alkalimetaller. Det betyder, at de tilhører gruppe 1 i det periodiske system.
2. Meget reaktivt:
- Alkalimetaller er kendt for deres høje reaktivitet. De mister let deres yderste elektron (valenselektron) for at danne positive ioner (kationer). Denne høje reaktivitet skyldes deres lave ioniseringsenergi.
3. Dannelse af basiske oxider og hydroxider:
- Når alkalimetaller reagerer med oxygen, danner de basiske oxider (f.eks. Na2O, Rb2O). På samme måde, når de reagerer med vand, danner de stærkt basiske hydroxider (f.eks. NaOH, RbOH).
4. Lav ioniseringsenergi:
- Alkalimetaller har lav ioniseringsenergi, fordi valenselektronen er løst bundet til kernen. Dette gør det nemt for dem at miste denne elektron, hvilket resulterer i dannelsen af positivt ladede ioner.
5. Skinnende og sølvfarvet udseende:
- Hydrogen, natrium og rubidium har alle et skinnende og sølvfarvet udseende på grund af deres metalliske natur.
6. Gode ledere af elektricitet og varme:
- Alkalimetaller er fremragende ledere af elektricitet og varme. Denne egenskab er et resultat af deres løst bundne valenselektroner, som kan bevæge sig frit inden for metallets krystalgitter.
Det er vigtigt at bemærke, at selvom hydrogen, natrium og rubidium deler disse ligheder som alkalimetaller, udviser de også unikke egenskaber og egenskaber, der adskiller dem fra hinanden.
 Varme artikler
Varme artikler
-
 Forskere i verden afslører først strukturen af et vigtigt lægemiddelmålKredit:Monash University Monash University-forskere har brugt en ny teknik til at afsløre strukturen af et vigtigt lægemiddelmål, åbner vejen for forbedrede behandlinger af kroniske sygdomme som
Forskere i verden afslører først strukturen af et vigtigt lægemiddelmålKredit:Monash University Monash University-forskere har brugt en ny teknik til at afsløre strukturen af et vigtigt lægemiddelmål, åbner vejen for forbedrede behandlinger af kroniske sygdomme som -
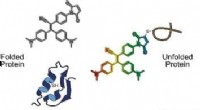 Molekylær sondekort forkert foldet proteometilstand i levende cellerKredit:Wiley Proteinernes foldningstilstand i levende celler afspejler ofte cellens generelle helbred. Australske forskere har udviklet en molekylær sonde, der registrerer proteometilstanden - hel
Molekylær sondekort forkert foldet proteometilstand i levende cellerKredit:Wiley Proteinernes foldningstilstand i levende celler afspejler ofte cellens generelle helbred. Australske forskere har udviklet en molekylær sonde, der registrerer proteometilstanden - hel -
 Nobelprisen for banebrydende måde at bygge molekyler på, der gjorde kemi grønnereList (til venstre) og MacMillan (til højre) er vindere af Nobelprisen i kemi i 2021. Kredit:NobelPrize.org, CC BY-SA Benjamin List og David MacMillan, fra henholdsvis Tyskland og USA, vil dele de
Nobelprisen for banebrydende måde at bygge molekyler på, der gjorde kemi grønnereList (til venstre) og MacMillan (til højre) er vindere af Nobelprisen i kemi i 2021. Kredit:NobelPrize.org, CC BY-SA Benjamin List og David MacMillan, fra henholdsvis Tyskland og USA, vil dele de -
 Både Sn- og Zn-enkeltatomer på CuO-katalysator fremmer synergistisk dimethyldichlorsilansyntese(A) AC HAADF-STEM billede af Sn1/CuO, (B) AC HAADF-STEM- og (C) HAADF-STEM-billeder samt de tilsvarende EDS-kortlægninger af 0.1Zn1-Sn1/CuO. De lyse prikker markeret med de røde cirkler på billede A o
Både Sn- og Zn-enkeltatomer på CuO-katalysator fremmer synergistisk dimethyldichlorsilansyntese(A) AC HAADF-STEM billede af Sn1/CuO, (B) AC HAADF-STEM- og (C) HAADF-STEM-billeder samt de tilsvarende EDS-kortlægninger af 0.1Zn1-Sn1/CuO. De lyse prikker markeret med de røde cirkler på billede A o
- Hvordan filosofi blev til fysik og virkelighedsinformation
- Top europæiske kokke tager elektrisk pulsfiskeri af menuen
- Forskerhold frigiver ny AI-model til vejr- og klimaapplikationer
- Tiltrækningskraft begrænser bevægelsespartiklerne mest i en fast flydende gas både og gas?
- Samtidig tuning af overfladestruktur og oxidationstilstand af kobberkatalysatorer
- Forskere opdager angribende svampe, der viser lovende mod smaragd askeborer


