Er eddikesyre en stærk syre?
Mens eddikesyre kan frigive H+ ioner, gør den det i meget mindre grad sammenlignet med stærke syrer, såsom saltsyre (HCl) eller svovlsyre (H2SO4). Stærke syrer dissocierer næsten fuldstændigt i vand, hvilket resulterer i en høj koncentration af H+ ioner og en lav pH. Omvendt har svage syrer en lavere grad af dissociation, hvilket resulterer i en højere pH sammenlignet med stærke syrer i samme koncentration.
Derfor falder eddikesyre under kategorien svage syrer, fordi den gennemgår begrænset dissociation i vand, hvilket resulterer i en delvist ioniseret opløsning med en relativt højere pH sammenlignet med opløsninger af stærke syrer.
Sidste artikelHvilket laboratorieapparat bruges til at tørre salte?
Næste artikelHvor mange atomer har natriumhydroxid?
 Varme artikler
Varme artikler
-
 Et nyt design til flow-batterierOpsætningen til at teste cellen af vanadium redox flow batteri. MEA er monteret på et stativ over den peristaltiske pumpe. Tankene er fyldt med vanadiumelektrolyt (før start af opladning). Kredit:St
Et nyt design til flow-batterierOpsætningen til at teste cellen af vanadium redox flow batteri. MEA er monteret på et stativ over den peristaltiske pumpe. Tankene er fyldt med vanadiumelektrolyt (før start af opladning). Kredit:St -
 Slut med at lege med ilden:Studiet giver indsigt i sikrere genopladelige batterierLithiumdendritter aflejret på overfladen af carbonelektroden detekteres ved hjælp af nuklear magnetisk resonans (NMR) analyse. Mængden af aflejret lithiumdendrit estimeres kvantitativt ud fra 7Li
Slut med at lege med ilden:Studiet giver indsigt i sikrere genopladelige batterierLithiumdendritter aflejret på overfladen af carbonelektroden detekteres ved hjælp af nuklear magnetisk resonans (NMR) analyse. Mængden af aflejret lithiumdendrit estimeres kvantitativt ud fra 7Li -
 Nanoporøst materiale samler forurening fra vandOmslaget af Uorganisk kemi illustrerer PNNLs arbejde med at optimere organiske metalrammer i nanostørrelse til at nette og fange en type industriel forurening, der findes i mange vandforsyninger ver
Nanoporøst materiale samler forurening fra vandOmslaget af Uorganisk kemi illustrerer PNNLs arbejde med at optimere organiske metalrammer i nanostørrelse til at nette og fange en type industriel forurening, der findes i mange vandforsyninger ver -
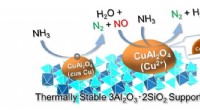 Ny katalysator gør ammoniak til et innovativt rent brændstofCuOx/3A2S producerer selektivt N 2 og H 2 O fra NH 3 gennem en to-trins reaktion. Kredit:Dr. Satoshi Hinokuma At træffe foranstaltninger mod klimaændringer og konvertere til samfund, der bru
Ny katalysator gør ammoniak til et innovativt rent brændstofCuOx/3A2S producerer selektivt N 2 og H 2 O fra NH 3 gennem en to-trins reaktion. Kredit:Dr. Satoshi Hinokuma At træffe foranstaltninger mod klimaændringer og konvertere til samfund, der bru
- Amerikanske samfund kortlægger varmeøer for at øge klimaets modstandsdygtighed
- Husjagtmyrer ved, hvordan man slipper besværet med at flytte
- Flight by Light:Mission fuldført for LightSail 2
- Kritisk Starbleed-sårbarhed i FPGA-chips identificeret
- Astronomer opdager kompleks flerkomponentudstrømning af galaksen NGC 7130
- I Tyskland har det hakkede bud på at sætte gang i kulanlæg


