Hvordan skriver man de kemiske formler for forbindelser med polyatomære ioner?
1. Identificer de ioner, der er til stede i forbindelsen :Bestem kationen (positiv ion) og den polyatomiske ion (negativ ion), der er til stede i forbindelsen.
2. Skriv symbolerne for ionerne :Brug de kemiske symboler for kationen og den polyatomiske ion. For eksempel Na+ for natriumion, Cl- for chloridion, SO4^2- for sulfation osv.
3. Bestem ladningerne af ionerne :Tjek ladningerne af de enkelte ioner. Polyatomiske ioner har normalt en netto negativ ladning, mens kationer har en netto positiv ladning.
4. Balancer afgifterne :Da forbindelser skal være elektrisk neutrale, skal den samlede positive ladning fra kationerne balancere den samlede negative ladning fra anionerne. Juster antallet af hver ion (koefficienter) efter behov for at opnå denne balance.
5. Skriv den kemiske formel :Kombiner symbolerne og koefficienterne for ionerne for at skrive den kemiske formel for forbindelsen. Indsæt den polyatomiske ion i parentes, hvis den indeholder mere end et atom.
Her er et par eksempler:
Natriumchlorid (NaCl) :Natriumion (Na+) har en ladning på +1, og chloridionen (Cl-) har en ladning på -1. En Na+-ion og en Cl-ion kombineres og danner en neutral forbindelse med den kemiske formel NaCl.
Calciumsulfat (CaSO4) :Calciumion (Ca2+) har en +2 ladning, og sulfationen (SO4^2-) har en -2 ladning. En Ca2+ ion og en SO4^2-ion kombineres for at danne en neutral forbindelse med den kemiske formel CaSO4.
Kaliumnitrat (KNO3) :Kaliumion (K+) har en +1 ladning, og nitrationen (NO3-) har en -1 ladning. En K+-ion og en NO3-ion kombineres og danner en neutral forbindelse med den kemiske formel KNO3.
 Varme artikler
Varme artikler
-
 Ethylensensor kan hjælpe med at overvåge plantesundhedKredit:American Chemical Society For at kontrollere blomstring og frugtmodning, planter frigiver det gasformige hormon ethylen. Miljøbetingelser, herunder tørke, saltindhold og patogener, kan også
Ethylensensor kan hjælpe med at overvåge plantesundhedKredit:American Chemical Society For at kontrollere blomstring og frugtmodning, planter frigiver det gasformige hormon ethylen. Miljøbetingelser, herunder tørke, saltindhold og patogener, kan også -
 Neutroner gør strukturelle ændringer i molekylære børster synligeDr. Lester Barnsley, instrumentforsker ved Forschungszentrum Juelich, ved det lillevinklede neutronspredningssystem KWS-1 i Heinz Maier-Leibnitz Zentrum ved Heinz Maier-Leibnitz Research Neutron Sourc
Neutroner gør strukturelle ændringer i molekylære børster synligeDr. Lester Barnsley, instrumentforsker ved Forschungszentrum Juelich, ved det lillevinklede neutronspredningssystem KWS-1 i Heinz Maier-Leibnitz Zentrum ved Heinz Maier-Leibnitz Research Neutron Sourc -
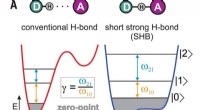 Eksperimenter med bifluoridioner viser tegn på hybridbindingerHydrogenbindinger. (A) Typer af hydrogenbindinger afhængigt af donor-acceptor afstand. Potentialer for protonbevægelse vises sammen med de tre første kvantenniveauer og de tilhørende laveste energiove
Eksperimenter med bifluoridioner viser tegn på hybridbindingerHydrogenbindinger. (A) Typer af hydrogenbindinger afhængigt af donor-acceptor afstand. Potentialer for protonbevægelse vises sammen med de tre første kvantenniveauer og de tilhørende laveste energiove -
 Perovskitter under tryk:Varme elektroner afkøles hurtigereKunstnerindtryk af, at ‘varme elektroner’ bliver hurtigere under pres. Varme elektroner under tryk slipper hurtigere af med deres overskydende energi. Kredit:thisillustrations.com I solceller, omk
Perovskitter under tryk:Varme elektroner afkøles hurtigereKunstnerindtryk af, at ‘varme elektroner’ bliver hurtigere under pres. Varme elektroner under tryk slipper hurtigere af med deres overskydende energi. Kredit:thisillustrations.com I solceller, omk
- Canadas gymnasiepensum giver ikke eleverne det fulde billede af klimaændringer
- Klimavenlige mikrober hugger døde planter uden at frigive varmefangende metan
- Forskere studerer, hvordan den truede Bairds tapir og bønder i Nicaragua kan eksistere sammen
- Lavpris ure til landing på månen
- Menneskelig hjerne supercomputer med 1 million processorer tændt for første gang
- Coronavirus sætter spørgsmålstegn ved PSA-Fiat Chrysler-fusionen


