Grundstoffer fra hvilke to grupper i det periodiske system højst sandsynligt ville kombineres med hinanden for at danne en ionisk forbindelse?
For eksempel, når natrium (Na) og chlor (Cl) reagerer, mister natriumatomet sin valenselektron til chloratomet og danner Na+ og Cl-ioner. Disse ioner kombineres derefter og danner den ioniske forbindelse natriumchlorid (NaCl).
Andre eksempler på ioniske forbindelser dannet mellem gruppe 1-elementer og gruppe 17-elementer omfatter kaliumfluorid (KF), calciumiodid (CaI2) og lithiumbromid (LiBr).
 Varme artikler
Varme artikler
-
 Forskere omdanner ultrahård pollen til fleksibelt materialeDette pollen-afledte materiale har potentialet til at fungere som en byggesten til design af nye kategorier af miljøvenlige materialer. Afbildet i forgrunden:svampe og papir afledt af pollen. Kredit:N
Forskere omdanner ultrahård pollen til fleksibelt materialeDette pollen-afledte materiale har potentialet til at fungere som en byggesten til design af nye kategorier af miljøvenlige materialer. Afbildet i forgrunden:svampe og papir afledt af pollen. Kredit:N -
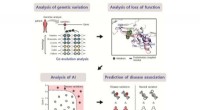 Evolutionær koblingsanalyse identificerer virkningen af sygdomsassocierede varianterSkematisk af den udviklede metode til at identificere virkningen af sygdomsassocierede varianter. Kredit:POSTECH Forudsigelse af virkningen af DNA-sekvensvarianter er vigtig for sortering af s
Evolutionær koblingsanalyse identificerer virkningen af sygdomsassocierede varianterSkematisk af den udviklede metode til at identificere virkningen af sygdomsassocierede varianter. Kredit:POSTECH Forudsigelse af virkningen af DNA-sekvensvarianter er vigtig for sortering af s -
 NIST pH standard referencematerialer understøtter en af fremstillingens mest målte egenskaberKredit:National Institute of Standards and Technology NIST har frigivet et pH -referencemateriale i en unikt stabil form til kalibrering af de instrumenter, der bruges af en lang række producenter
NIST pH standard referencematerialer understøtter en af fremstillingens mest målte egenskaberKredit:National Institute of Standards and Technology NIST har frigivet et pH -referencemateriale i en unikt stabil form til kalibrering af de instrumenter, der bruges af en lang række producenter -
 Borat bioaktivt glas i nanoskala:Et næste generations materiale til hudhelingBorat bioaktivt glas i nanoskala. Kredit:MA Kun For nylig, ved hjælp af en steady-state stærk magnetfelt eksperimentel enhed, forskere konstruerede bioaktivt boratglas i nanoskala (Nano-HCA@BG), s
Borat bioaktivt glas i nanoskala:Et næste generations materiale til hudhelingBorat bioaktivt glas i nanoskala. Kredit:MA Kun For nylig, ved hjælp af en steady-state stærk magnetfelt eksperimentel enhed, forskere konstruerede bioaktivt boratglas i nanoskala (Nano-HCA@BG), s
- Omdefinering af grænserne for målenøjagtighed
- Økonomiske konsekvenser af COVID-19 vil gøre kampen mod klimaændringer sværere
- Børn risikerer generationskatastrofe fra COVID:vagthund
- Kortlægning og måling af proteiner på overfladerne af endoplasmatisk reticulum (ER) i celler
- To forkerte forsøg på at gøre en ret:Makeup-opkald er almindelige for MLB-dommere, finansielle an…
- Rum havearbejde


