Hvorfor stiger den procentvise ionisering af eddikesyre, når koncentrationen af opløsningen falder?
Overvej for eksempel ioniseringen af eddikesyre i vand:
$$CH_3COOH + H_2O ⇌ CH_3COO^- + H_3O^+$$
Indledningsvis er koncentrationen af uioniseret eddikesyre relativt høj, så baseret på Le Châteliers princip og ligevægtskonstantudtryk nedenfor, ligger ligevægtspositionen på venstre side og favoriserer reaktanterne; der er relativt lave koncentrationer af H+ og A-ioner:
$$K_a =\frac{[CH_3COO^-][H_3O^+]}{[CH_3COOH]}$$
Når koncentrationen af eddikesyre falder (gennem fortynding), skifter ligevægten mod højre. Dette skift sker, fordi der ikke er nok eddikesyremolekyler i opløsningen til at reagere med de fleste H+ og A- ioner. Derfor stiger koncentrationen af både H+ og A-ioner, hvilket fører til en højere dissociation eller ionisering af eddikesyrer i en fortyndet opløsning.
 Varme artikler
Varme artikler
-
 Et lovende gennembrud for et bedre design af elektroniske materialerKredit:Pixabay/CC0 Public Domain At finde de bedste materialer til morgendagens elektronik er målet for professor Emanuele Orgiu fra Institut national de la recherche scientifique (INRS). Blandt d
Et lovende gennembrud for et bedre design af elektroniske materialerKredit:Pixabay/CC0 Public Domain At finde de bedste materialer til morgendagens elektronik er målet for professor Emanuele Orgiu fra Institut national de la recherche scientifique (INRS). Blandt d -
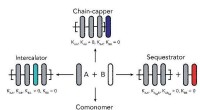 Styring af længden af supramolekylære polymererIllustration af, hvordan tilsætning af en anden supramolekylær polymer kan påvirke copolymerens længde. Kredit:Eindhoven University of Technology Systemer, der består af én supramolekylær polymer,
Styring af længden af supramolekylære polymererIllustration af, hvordan tilsætning af en anden supramolekylær polymer kan påvirke copolymerens længde. Kredit:Eindhoven University of Technology Systemer, der består af én supramolekylær polymer, -
 Fremstilling af metal med luftens lethedEn myg, der står på bomuldsfibre, bærer en prøve af guld-aerogel med ultra-lav densitet. Kredit:Joshua DeOtte Guld, sølv og kobber er tungmetaller, men LLNL-forskere kan nu gøre dem næsten lige så
Fremstilling af metal med luftens lethedEn myg, der står på bomuldsfibre, bærer en prøve af guld-aerogel med ultra-lav densitet. Kredit:Joshua DeOtte Guld, sølv og kobber er tungmetaller, men LLNL-forskere kan nu gøre dem næsten lige så -
 Løsning af livets mysterier:Krystallografer identificerer 1, 000 proteinstrukturerPDB ID:6B0S Den canadiske lyskilde fejrer to milepæle nået af videnskabsmænd, der har udført forskning på den nationale facilitet ved University of Saskatchewan. Forskere har løst 1, 000 proteins
Løsning af livets mysterier:Krystallografer identificerer 1, 000 proteinstrukturerPDB ID:6B0S Den canadiske lyskilde fejrer to milepæle nået af videnskabsmænd, der har udført forskning på den nationale facilitet ved University of Saskatchewan. Forskere har løst 1, 000 proteins
- Hvor mange oz sukker er lig med 110 gram?
- Nyt hydroxyapatit-målrettet nanolægemiddel kan være et paradigmeskifte for kræftbehandling
- Kan fremmede solpaneler være teknosignaturer?
- Tusindvis år gammel egyptisk sarkofag åbnede på direkte tv
- Jack Horner
- Udviklere i England vil blive tvunget til at skabe levesteder for dyreliv - her er, hvordan det fung…


