Forskellen mellem ammoniumsufid og sulfit?
Komposition :
- Ammoniumsulfid (NH4)2S:Den er sammensat af to ammonium (NH4) ioner og en sulfid (S) ion.
- Ammoniumsulfit (NH4)2SO3:Den består af to ammonium (NH4) ioner og en sulfit (SO3) ion.
Egenskaber :
- Ammoniumsulfid er et farveløst til gulbrunt krystallinsk fast stof, der har en tydelig skarp lugt af rådne æg. Det er meget opløseligt i vand og nedbrydes ved udsættelse for luft og frigiver svovlbrintegas (H2S).
- Ammoniumsulfit er et hvidt krystallinsk fast stof med en svag svovlagtig lugt. Det er opløseligt i vand og nedbrydes langsomt i luft for at frigive svovldioxidgas (SO2).
Reaktivitet :
- Ammoniumsulfid er en mere reaktiv forbindelse sammenlignet med ammoniumsulfit. Det reagerer med syrer for at frigive svovlbrintegas, som er giftigt og har en stærk ubehagelig lugt.
- Ammoniumsulfit er mindre reaktiv og opfører sig som et reduktionsmiddel i kemiske reaktioner. Det kan undergå oxidation for at danne sulfationer (SO4) eller undergå reduktion for at danne sulfidioner (S).
Anvendelser :
- Ammoniumsulfid bruges primært som en kilde til sulfidioner i forskellige industrielle processer. Det er almindeligt anvendt i læder- og tekstilindustrien til lædergarvning, farvning og tekstiltryk. Den finder også anvendelse i fotografering, metalbearbejdning og som reagens i kemisk analyse.
- Ammoniumsulfit bruges som reduktionsmiddel i forskellige industrier. Det er almindeligt anvendt i fødevareindustrien som et konserveringsmiddel for at forhindre fordærvelse og bevare farven på frugter, grøntsager og visse kødprodukter. Derudover bruges det til fotografering, tekstilfremstilling og som et analytisk reagens.
Sammenfattende er ammoniumsulfid og ammoniumsulfit forskellige forbindelser med forskellige egenskaber, reaktiviteter og anvendelser. Ammoniumsulfid er mere reaktivt og frigiver hydrogensulfidgas, mens ammoniumsulfit er mindre reaktivt og fungerer som et reduktionsmiddel. De bruges begge i forskellige industrier, men deres specifikke anvendelser afhænger af deres unikke egenskaber.
 Varme artikler
Varme artikler
-
 Video:Hvordan tåregas påvirker din kropKredit:The American Chemical Society 2-chlorbenzalmalononitril, bedre kendt som CS-gas, er en af de mest almindelige tåregasser, der bruges i USA i dag, men vidste du, at det faktisk ikke er en
Video:Hvordan tåregas påvirker din kropKredit:The American Chemical Society 2-chlorbenzalmalononitril, bedre kendt som CS-gas, er en af de mest almindelige tåregasser, der bruges i USA i dag, men vidste du, at det faktisk ikke er en -
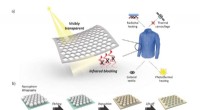 Ny nanofotonisk belægning kunne hjælpe med termisk styring og modovervågninga) Skematisk af VTIR for at blokere emissionen af termisk stråling til strålingsopvarmning og termisk camouflage. b) Skematisk fremstilling af fremstillingsprocessen og SEM-billeder for VTIR-belægni
Ny nanofotonisk belægning kunne hjælpe med termisk styring og modovervågninga) Skematisk af VTIR for at blokere emissionen af termisk stråling til strålingsopvarmning og termisk camouflage. b) Skematisk fremstilling af fremstillingsprocessen og SEM-billeder for VTIR-belægni -
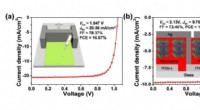 Organiske småmolekyle hultransporterende lag mod effektive p-i-n perovskit solcellerPero-SCer baseret på bladbelagt BDT-TPA-sTh HTL- og MAPbI3-aktivt lag:(a) J-V-kurver i omvendt scanningsretning; indsats:skematisk illustration af bladbelagte HTLer. (b) J-V-kurver for et 1 cm2 pero-S
Organiske småmolekyle hultransporterende lag mod effektive p-i-n perovskit solcellerPero-SCer baseret på bladbelagt BDT-TPA-sTh HTL- og MAPbI3-aktivt lag:(a) J-V-kurver i omvendt scanningsretning; indsats:skematisk illustration af bladbelagte HTLer. (b) J-V-kurver for et 1 cm2 pero-S -
 Bekæmper evigt kemikalier med mikroberKredit:Pixabay/CC0 Public Domain Per- og polyfluoroalkylstoffer (PFAS) er nogle af de mest persistente miljøforurenende stoffer, tjene dem monikeren evigt kemikalier. Stigende bekymring for de neg
Bekæmper evigt kemikalier med mikroberKredit:Pixabay/CC0 Public Domain Per- og polyfluoroalkylstoffer (PFAS) er nogle af de mest persistente miljøforurenende stoffer, tjene dem monikeren evigt kemikalier. Stigende bekymring for de neg
- Uhøflig opførsel på arbejdet er ikke en epidemi, viser ny undersøgelse
- Hvad er den mest almindelige isotop for bor?
- Sådan fungerer sorte lys
- Et spor af galakser i hjertet af en gigantisk galaksehob
- Våben, der ikke bruges af britiske betjente i de fleste politihændelser, der involverer magt, data…
- Innovativ flad optik vil indlede den næste teknologiske revolution


