En 10,0 ml prøve af vandig hcl kræver 26,13 ml 0,108 m naoh for at nå endepunktet hvad er molær koncentration hcl?
$$HCl + NaOH \rightarrow NaCl + H_2O$$
Ud fra ligningen kan vi se, at 1 mol HCl reagerer med 1 mol NaOH. Derfor kan antallet af mol HCl i 10,0 ml prøven beregnes som følger:
$$mol HCl =(26,13 mL)(0,108 M) =2,812 \ gange 10^{-3} mol$$
Den molære koncentration af HCl i den oprindelige prøve kan beregnes ved at dividere antallet af mol HCl med prøvens volumen i liter:
$$ molaritet af HCl =\frac{2,812 \times 10^{-3} mol}{10,0 \times 10^{-3} L} =0,2812 M$$
Derfor er den molære koncentration af HCl i den originale prøve 0,2812 M.
Sidste artikelHvordan kunne man adskille zinkchlorid fra siliciumoxid?
Næste artikelHvad er pH for calciumhydroxid?
 Varme artikler
Varme artikler
-
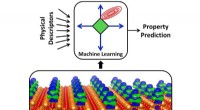 Undersøgelse viser, at maskinlæring kan forbedre katalytisk designEn kvantekemisk simulering (nederste panel) viser ladningsoverførslen (blå/grøn) mellem metalatomer og en underliggende støtte (orange). Dette er kun én beskrivelse af en katalysators fysiske adfærd,
Undersøgelse viser, at maskinlæring kan forbedre katalytisk designEn kvantekemisk simulering (nederste panel) viser ladningsoverførslen (blå/grøn) mellem metalatomer og en underliggende støtte (orange). Dette er kun én beskrivelse af en katalysators fysiske adfærd, -
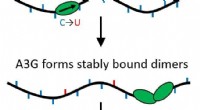 En hvis ved at redigere, to ved vejspærring:Humant protein bekæmper HIV som monomer og dimerForskning for nylig offentliggjort i Naturkommunikation undersøger mulighederne for et humant protein, der hæmmer HIV-1, APOBEC3G (A3G). Papiret fremhæver arbejdet af Northeastern Physics professor
En hvis ved at redigere, to ved vejspærring:Humant protein bekæmper HIV som monomer og dimerForskning for nylig offentliggjort i Naturkommunikation undersøger mulighederne for et humant protein, der hæmmer HIV-1, APOBEC3G (A3G). Papiret fremhæver arbejdet af Northeastern Physics professor -
 Video:Hvordan tåregas påvirker din kropKredit:The American Chemical Society 2-chlorbenzalmalononitril, bedre kendt som CS-gas, er en af de mest almindelige tåregasser, der bruges i USA i dag, men vidste du, at det faktisk ikke er en
Video:Hvordan tåregas påvirker din kropKredit:The American Chemical Society 2-chlorbenzalmalononitril, bedre kendt som CS-gas, er en af de mest almindelige tåregasser, der bruges i USA i dag, men vidste du, at det faktisk ikke er en -
 Lille skala, store forbedringerKredit:George Hodan/public domain Metoder til at forbedre vandrensning eller bygge bedre batterier er problemer, som har udfordret videnskabsmænd i årtier. Fremskridtene er gået fremad, men stigen
Lille skala, store forbedringerKredit:George Hodan/public domain Metoder til at forbedre vandrensning eller bygge bedre batterier er problemer, som har udfordret videnskabsmænd i årtier. Fremskridtene er gået fremad, men stigen
- Skoler bruger forskning til at forsøge at forbedre børns læring - men det virker ikke
- Livsspænding af Lobsters
- Bag kulisserne for gendannelse af NASAs Hubble
- Hvad er et eksempel på støkiometri?
- Forskere opdager, hvordan CRISPR/Cas stjæler fremmed DNA til det bakterielle immunsystem
- Skifteelement af Cr2O3 kan give mindre, mere energieffektiv hukommelse til computere og flashdrev


