Hvorfor er metaller meget gode ledere af elektricitet en kovalent binding c ionisk B De skinnende og hårde d delokaliserede valenselektroner?
Metaller er gode ledere af elektricitet på grund af tilstedeværelsen af delokaliserede valenselektroner. Disse elektroner er ikke bundet til noget bestemt atom og kan frit bevæge sig gennem metalgitteret. Når et elektrisk felt påføres, kan disse elektroner bevæge sig frit og bære den elektriske strøm.
De andre muligheder er forkerte, fordi:
a) Kovalent binding: Kovalent binding er en type kemisk binding, hvor elektroner deles mellem atomer. Denne type binding er ikke ansvarlig for metallers elektriske ledningsevne.
b) De er skinnende og hårde: Metallers skinnende og hårde natur skyldes deres tæt pakkede atomstrukturer. Dette bidrager ikke direkte til deres elektriske ledningsevne.
c) Ionbinding: Ionisk binding er en type kemisk binding, hvor elektroner overføres fra et atom til et andet. Denne type binding er ikke ansvarlig for metallers elektriske ledningsevne.
 Varme artikler
Varme artikler
-
 Enkeltkrystallinske kvaternære sulfid -nanobelterKobberbaserede kvaternære sulfid-nanomaterialer, især for Cu-Zn-In-S (CZIS) og Cu-Zn-Ga-S (CZGS), som består af giftfri elementer er attraktive kandidater til solfotokatalytisk brintproduktion på grun
Enkeltkrystallinske kvaternære sulfid -nanobelterKobberbaserede kvaternære sulfid-nanomaterialer, især for Cu-Zn-In-S (CZIS) og Cu-Zn-Ga-S (CZGS), som består af giftfri elementer er attraktive kandidater til solfotokatalytisk brintproduktion på grun -
 Forbedret proteinfunktion åbner vej for nyt koncept for lægemiddeludviklingKredit:CC0 Public Domain Forskere ved Karolinska Institutet og SciLifeLab i Sverige beskriver i en undersøgelse offentliggjort i Science hvordan de har forbedret et proteins evne til at reparere ox
Forbedret proteinfunktion åbner vej for nyt koncept for lægemiddeludviklingKredit:CC0 Public Domain Forskere ved Karolinska Institutet og SciLifeLab i Sverige beskriver i en undersøgelse offentliggjort i Science hvordan de har forbedret et proteins evne til at reparere ox -
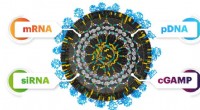 Opdagelse af et universelt system til transport af nukleinsyrer ind i cellerNanopartiklernes alsidighed ligger i, at de kan fungere lige godt for forskellige nukleinsyrer. Dette kan fremskynde lægemiddeludviklingen betydeligt. Kredit:Tomas Bellon / IOCB Prag Forskere fra
Opdagelse af et universelt system til transport af nukleinsyrer ind i cellerNanopartiklernes alsidighed ligger i, at de kan fungere lige godt for forskellige nukleinsyrer. Dette kan fremskynde lægemiddeludviklingen betydeligt. Kredit:Tomas Bellon / IOCB Prag Forskere fra -
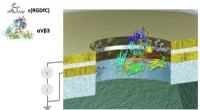 Heavy metal torden:Protein kan tændes for at lede elektricitet som et metalLindsay udforskede interaktionerne mellem et protein, kaldet et integrin (alphaVbeta3), og dets mål, kaldet en ligand (RGDfC). Lindsays team var i stand til at fremstille en nanoenhed til mere fint at
Heavy metal torden:Protein kan tændes for at lede elektricitet som et metalLindsay udforskede interaktionerne mellem et protein, kaldet et integrin (alphaVbeta3), og dets mål, kaldet en ligand (RGDfC). Lindsays team var i stand til at fremstille en nanoenhed til mere fint at


