Hvad er den empiriske formel for forbindelse med et bestemt fluorid vanadium 40,13 procent i vanaium?
Lad os antage, at vi har 100 g af forbindelsen. Det betyder, at der er 40,13 g vanadium og 59,87 g fluor.
For at konvertere masserne til mol skal vi dividere med de respektive molære masser:
Mol vanadium =40,13 g / 50,94 g/mol =0,787 mol
Mol fluor =59,87 g / 18,99 g/mol =3,15 mol
For at bestemme den empiriske formel skal vi finde det enkleste hele talforhold mellem mol vanadium og fluor. Vi kan dividere begge mol med det mindste antal mol for at opnå dette:
Mol vanadium (forenklet) =0,787 mol / 0,787 mol =1
Mol fluor (forenklet) =3,15 mol / 0,787 mol =4
Derfor er den empiriske formel for forbindelsen VF4.
 Varme artikler
Varme artikler
-
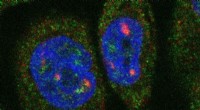 Design af lægemidler rettet mod en anden del af livets kodeIndividuelle RNA-molekyler fluorescerer inde i en brystkræftcelle. Kredit:Sunjong Kwon, Oregon Health &Science University, via Flickr De fleste lægemidler virker ved at pille ved proteiners adfærd
Design af lægemidler rettet mod en anden del af livets kodeIndividuelle RNA-molekyler fluorescerer inde i en brystkræftcelle. Kredit:Sunjong Kwon, Oregon Health &Science University, via Flickr De fleste lægemidler virker ved at pille ved proteiners adfærd -
 Ny måde at se på cellemembraner på kan ændre den måde, vi studerer sygdom påKredit:CC0 Public Domain En ny teknik til at studere intakte dele af cellemembraner kunne revolutionere undersøgelser af kræft, metaboliske og hjertesygdomme. Membraner beskytter alle vores celle
Ny måde at se på cellemembraner på kan ændre den måde, vi studerer sygdom påKredit:CC0 Public Domain En ny teknik til at studere intakte dele af cellemembraner kunne revolutionere undersøgelser af kræft, metaboliske og hjertesygdomme. Membraner beskytter alle vores celle -
 Fremstilling af N-C-bindinger direkte fra dinitrogen:Sammenfatning og perspektivKredit:CC0 Public Domain Som den mest rigelige bestanddel i Jordens atmosfære, dinitrogen (N 2 ) er den vigtigste nitrogenkilde til N-holdige forbindelser i Jorden. Derfor, N 2 fiksering og ak
Fremstilling af N-C-bindinger direkte fra dinitrogen:Sammenfatning og perspektivKredit:CC0 Public Domain Som den mest rigelige bestanddel i Jordens atmosfære, dinitrogen (N 2 ) er den vigtigste nitrogenkilde til N-holdige forbindelser i Jorden. Derfor, N 2 fiksering og ak -
 Forskere kaster nyt lys over molekylær adfærdKredit:CC0 Public Domain Forskere ved Heriot-Watt University har udviklet et nyt eksperiment, der har afsløret aldrig før set molekylær adfærd. Et team af forskere ledet af professor Matt Costen
Forskere kaster nyt lys over molekylær adfærdKredit:CC0 Public Domain Forskere ved Heriot-Watt University har udviklet et nyt eksperiment, der har afsløret aldrig før set molekylær adfærd. Et team af forskere ledet af professor Matt Costen


