Hvad er reaktionen mellem ZnSO4 og Cu?
ZnSO4 + Cu → Zn + CuS04
I denne reaktion gennemgår zinksulfat (ZnSO4) og kobber (Cu) en enkeltfortrængningsreaktion. Under denne reaktion fortrænger det mere reaktive metal, som er zink (Zn), det mindre reaktive metal, som er kobber (Cu), fra dets saltopløsning. Som et resultat dannes der metallisk zink (Zn), og der produceres kobbersulfat (CuSO4).
Reaktionen kan forstås ud fra reaktiviteten af de involverede metaller. Zink er mere reaktivt end kobber, hvilket betyder, at det har en større tendens til at miste elektroner og danne positive ioner. Når et stykke kobbermetal anbringes i en opløsning af zinksulfat, tiltrækkes zinkionerne (Zn²⁺) i opløsningen stærkere af elektronerne i kobbermetallet, end kobberionerne (Cu²⁺) er til elektronerne i zink metal. Denne forskel i tiltrækning får zinkionerne til at blive reduceret til zinkmetal (Zn), mens kobberionerne oxideres til kobbersulfat (CuSO4).
Den samlede reaktion er repræsenteret ved følgende ligning:
Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s)
Sammenfattende, når ZnSO4 og Cu reagerer, fortrænger zink kobber fra sin saltopløsning, hvilket resulterer i dannelsen af metallisk zink og kobbersulfat.
 Varme artikler
Varme artikler
-
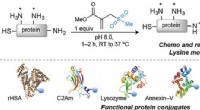 Sådan udløser en kemisk kædereaktionSkræddersyede proteinlægemidler i kampen mod kræft og andre sygdomme er et skridt tæt på, med Center for NanoScale Science and Technology på Flinders, der spiller en rolle i en af de nyeste kemifund
Sådan udløser en kemisk kædereaktionSkræddersyede proteinlægemidler i kampen mod kræft og andre sygdomme er et skridt tæt på, med Center for NanoScale Science and Technology på Flinders, der spiller en rolle i en af de nyeste kemifund -
 Videnskabelige fremskridt kan gøre det lettere at genanvende plastKredit:CC0 Public Domain De fleste af de 150 millioner tons plastik, der produceres rundt om i verden hvert år, ender på lossepladser, havene og andre steder. Mindre end 9 procent af plasten genan
Videnskabelige fremskridt kan gøre det lettere at genanvende plastKredit:CC0 Public Domain De fleste af de 150 millioner tons plastik, der produceres rundt om i verden hvert år, ender på lossepladser, havene og andre steder. Mindre end 9 procent af plasten genan -
 Ny teknik kan hjælpe med at konstruere forurenet vandfilter, menneskeligt vævBlomstformede biomaterialer ved hjælp af konstruerede proteinbyggesten. Kredit:Nancy Hernandez, William Hansen og Slava Manichev Forskere kan forvandle proteiner til uendelige mønstre, der ligner
Ny teknik kan hjælpe med at konstruere forurenet vandfilter, menneskeligt vævBlomstformede biomaterialer ved hjælp af konstruerede proteinbyggesten. Kredit:Nancy Hernandez, William Hansen og Slava Manichev Forskere kan forvandle proteiner til uendelige mønstre, der ligner -
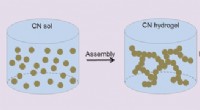 Carbonitrid aerogeler formidler den fotokatalytiske omdannelse af vandKredit:Wiley Nanokemi opfylder makrostrukturer:Kinesiske forskere rapporterer syntesen af en makroskopisk aerogel fra carbonitrid-nanomaterialer, som er en glimrende katalysator for den vandopde
Carbonitrid aerogeler formidler den fotokatalytiske omdannelse af vandKredit:Wiley Nanokemi opfylder makrostrukturer:Kinesiske forskere rapporterer syntesen af en makroskopisk aerogel fra carbonitrid-nanomaterialer, som er en glimrende katalysator for den vandopde
- Kvantesimulering af kvantekrystaller
- Kan en ny type gletsjer på Mars hjælpe fremtidige astronauter?
- Hvad er tre bølger, der kræver et medium?
- Ændringer i arealanvendelse har varmet Jordens overflade
- Atomenergiprogrammer øger ikke sandsynligheden for spredning, undersøgelse finder
- Nyt AI-system med dyb viden kunne løse flaskehalse i lægemiddelforskning


