Er fosforsyre stærk eller svag syre?
En svag syre er en syre, der kun delvist dissocierer i vand, hvilket betyder, at den ikke bryder fuldstændigt ind i sine ioner, når den opløses i vand. I stedet etablerer det en ligevægt mellem den udissocierede syre og dens ioner. Dissociationen af phosphorsyre kan repræsenteres af følgende kemiske ligninger:
$$H_3PO_4 \rightleftharpoons H^+ + H_2PO_4^-$$
Ligevægtskonstanten for denne reaktion er angivet som $K_a1$ og er lig med:
$$K_{a1} =\frac{[H^+][H_2PO_4^-]}{[H_3PO_4]}$$
Værdien af $K_{a1}$ er 7,5 * 10 -3 ved 25°C. Dette indikerer, at fosforsyre er en svag syre, da dens $K_{a}$ værdi er mindre end 1.
Fosforsyre kan også gennemgå yderligere dissociationstrin for at frigive de resterende hydrogenioner:
$$H_2PO_4^- \rightleftharpoons H^+ + HPO_4^{2-}$$
Ligevægtskonstanten for denne reaktion er angivet som $K_{a2}$ og er lig med:
$$K_{a2} =\frac{[H^+][HPO_4^{2-}]}{[H_2PO_4^-]}$$
Værdien af $K_{a2}$ er 6,2 * 10 -8 ved 25°C.
$$HPO_4^{2-} \rightleftharpoons H^+ + PO_4^{3-}$$
Ligevægtskonstanten for denne reaktion er angivet som $K_{a3}$ og er lig med:
$$K_{a3} =\frac{[H^+][PO_4^{3-}]}{[HPO_4^{2-}]}$$
Værdien af $K_{a3}$ er 4,8 * 10 -13 ved 25°C.
Disse værdier indikerer, at phosphorsyre er en stærkere syre end mange andre svage syrer, såsom eddikesyre, men svagere end stærke syrer, såsom saltsyre, som fuldstændig dissocierer i vand.
 Varme artikler
Varme artikler
-
 Skærende lysstråler er nøglen til transformativt 3D-printerpotentialeSkematisk reaktionsoversigt. Tofarvet aktivering af et stabilt cyclobutenedion (UV-lys) og rødforskudt ortho-substitueret tetrachlorid-azobenzen (orange lys) muliggør dannelse af ligeret produkt ved p
Skærende lysstråler er nøglen til transformativt 3D-printerpotentialeSkematisk reaktionsoversigt. Tofarvet aktivering af et stabilt cyclobutenedion (UV-lys) og rødforskudt ortho-substitueret tetrachlorid-azobenzen (orange lys) muliggør dannelse af ligeret produkt ved p -
 Skinnende molekyler skelner mellem proteiner i hjernenHjernevæv med Alzheimers patologi, farvet med et af de nye tau-specifikke molekyler (orange) og et af de molekyler, der tidligere er udviklet af gruppen ved LiU (blå). Billedet er taget i et fluoresce
Skinnende molekyler skelner mellem proteiner i hjernenHjernevæv med Alzheimers patologi, farvet med et af de nye tau-specifikke molekyler (orange) og et af de molekyler, der tidligere er udviklet af gruppen ved LiU (blå). Billedet er taget i et fluoresce -
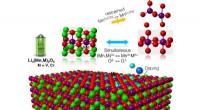 Forskere forudser materialer til at stabilisere et lithium-ion-batteri med rekordhøj kapacitetEn skematisk illustration af batteriets katodestruktur, hvor litium er rødt, ilt er grønt, mangan er lilla, krom er mørkeblå og vanadium er lyseblå. Kredit:Wolverton Research Group, Northwestern Unive
Forskere forudser materialer til at stabilisere et lithium-ion-batteri med rekordhøj kapacitetEn skematisk illustration af batteriets katodestruktur, hvor litium er rødt, ilt er grønt, mangan er lilla, krom er mørkeblå og vanadium er lyseblå. Kredit:Wolverton Research Group, Northwestern Unive -
 Forskning i perovskit-silicium tandemceller viser ny vej at gåNREL-forskerne Chuanxiao Xiao (til venstre) og Kai Zhu samarbejdede med forskere fra Republikken Korea for at validere potentialet af perovskit-silicium tandem solceller til at opnå mere end 30 % effe
Forskning i perovskit-silicium tandemceller viser ny vej at gåNREL-forskerne Chuanxiao Xiao (til venstre) og Kai Zhu samarbejdede med forskere fra Republikken Korea for at validere potentialet af perovskit-silicium tandem solceller til at opnå mere end 30 % effe
- Ven, fjende eller dronning? Undersøgelse fremhæver kompleksiteten af myreopfattelse
- Installation af liv understøtter den håndfri måde
- Hvordan coronavirus har fremhævet behovet for bedre transport i landdistrikterne
- Hvilke grundstoffer udgør natriumhypochlorit?
- Definition af Endpoint Titration
- Forudsiger skæbne for olieudslip i arktisk havis


