Hvad er gruppen af det periodiske system?
Her er navnene og karakteristika for hver gruppe:
Gruppe 1: Også kendt som alkalimetallerne er disse grundstoffer meget reaktive og danner basiske oxider. De har 1 valenselektron.
Eksempler:Lithium (Li), Natrium (Na), Kalium (K)
Gruppe 2: Kendt som jordalkalimetallerne er disse grundstoffer moderat reaktive og danner basiske oxider. De har 2 valenselektroner.
Eksempler:Beryllium (Be), Magnesium (Mg), Calcium (Ca)
Gruppe 13: Også kaldet trielerne, disse grundstoffer har 3 valenselektroner og danner typisk forbindelser i +3 oxidationstilstanden.
Eksempler:Bor (B), Aluminium (Al), Gallium (Ga)
Gruppe 14: Benævnt tetrelerne har disse grundstoffer 4 valenselektroner og har tendens til at danne kovalente forbindelser.
Eksempler:Kulstof (C), Silicium (Si), Germanium (Ge)
Gruppe 15: Også kendt som pnictogenerne har disse elementer 5 valenselektroner og udviser almindeligvis oxidationstilstande på +5, +3 eller -3.
Eksempler:Nitrogen (N), Fosfor (P), Arsen (As)
Gruppe 16: Kaldet chalcogenerne, disse grundstoffer har 6 valenselektroner og danner forbindelser med forskellige oxidationstilstande.
Eksempler:Ilt (O), Svovl (S), Selen (Se)
Gruppe 17: Kendt som halogenerne, er disse grundstoffer meget reaktive ikke-metaller, der danner salte med metaller. De har 7 valenselektroner.
Eksempler:Fluor (F), Klor (Cl), Brom (Br)
Gruppe 18: Også kaldet ædelgasser, disse grundstoffer er ekstremt ureaktive og har en komplet ydre elektronskal.
Eksempler:Helium (He), Neon (Ne), Argon (Ar)
At forstå disse grupper er afgørende for at forudsige grundstoffernes kemiske adfærd og egenskaber baseret på deres position i det periodiske system.
Sidste artikelEr naphthalen opløseligt til ethylalkohol?
Næste artikelHvordan forbereder du 2.5N h2so4?
 Varme artikler
Varme artikler
-
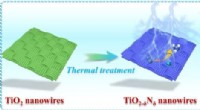 Overfladedefektkonstruktion af nanowire-arrays mod effektiv nitrogenreduktion til ammoniaksynteseKatalysatorerne er baseret på TiO2−δ Nδ nanotråde dyrket på kulstof har et højere udbytte for ammoniak end elektrokatalysatoren uden N-doping. Kredit:Journal of Energy Chemistry Ammoniak er en kul
Overfladedefektkonstruktion af nanowire-arrays mod effektiv nitrogenreduktion til ammoniaksynteseKatalysatorerne er baseret på TiO2−δ Nδ nanotråde dyrket på kulstof har et højere udbytte for ammoniak end elektrokatalysatoren uden N-doping. Kredit:Journal of Energy Chemistry Ammoniak er en kul -
 Styring af kemiske reaktioner nær det absolutte nulKredit:CC0 Public Domain Det er en underdrivelse at sige, at kemiske reaktioner finder sted overalt, konstant. Både i naturen og i laboratoriet, kemi er allestedsnærværende. Men på trods af fremsk
Styring af kemiske reaktioner nær det absolutte nulKredit:CC0 Public Domain Det er en underdrivelse at sige, at kemiske reaktioner finder sted overalt, konstant. Både i naturen og i laboratoriet, kemi er allestedsnærværende. Men på trods af fremsk -
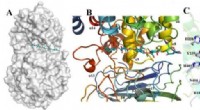 Strukturer i tang kaster lys over bæredygtighedOverfladerepræsentation og substratbindingsrille på Dp0100 Kredit:JI Shiqi Brunalger er ikke bare tang, der flyder i havet og floker svømmernes fødder - de indeholder også en hemmelighed. I sin ce
Strukturer i tang kaster lys over bæredygtighedOverfladerepræsentation og substratbindingsrille på Dp0100 Kredit:JI Shiqi Brunalger er ikke bare tang, der flyder i havet og floker svømmernes fødder - de indeholder også en hemmelighed. I sin ce -
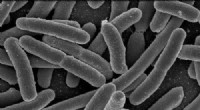 Knækning af colibactins kode:Undersøgelse undersøger, hvordan sammensatte beskadigede DNA for at …Escherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH I mere end et årti, forskere har arbejdet på at forstå sammenhængen mellem colibactin, en forbindelse fremstillet af visse stammer
Knækning af colibactins kode:Undersøgelse undersøger, hvordan sammensatte beskadigede DNA for at …Escherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH I mere end et årti, forskere har arbejdet på at forstå sammenhængen mellem colibactin, en forbindelse fremstillet af visse stammer


