Hvilket molekyle har et dipolmoment H2 CO2 F2 SO2 BF3?
Af de givne molekyler er CO2 og BF3 upolære molekyler, hvilket betyder, at de ikke har et dipolmoment. Dette skyldes, at elektronegativiteten af kulstof- og oxygenatomer i CO2 er næsten den samme, hvilket resulterer i en symmetrisk fordeling af elektroner omkring molekylet. På samme måde er elektronegativiteten af bor- og fluoratomer i BF3 også næsten den samme, hvilket fører til en symmetrisk elektronfordeling.
H2, F2 og SO2 er polære molekyler og har dipolmomenter. I H2 er elektronegativiteten af hydrogenatomer lidt anderledes, hvilket forårsager en lille ubalance i elektronfordelingen, hvilket resulterer i et dipolmoment. I F2 skaber elektronegativiteten af fluoratomer en signifikant forskel i elektronfordelingen, hvilket resulterer i et betydeligt dipolmoment. I SO2 fører elektronegativiteten af oxygen- og svovlatomer til en forvrænget elektronsky, der skaber et dipolmoment.
Derfor er molekylerne med et dipolmoment:H2, F2 og SO2.
Sidste artikelHvilken slags salte får du i HNO3?
Næste artikelHvorfor er brints position ikke fikseret i aktivitetsserier?
 Varme artikler
Varme artikler
-
 Molekylært stillads til modificering af fluorescerende forbindelser, der anvendes til biologisk bil…Et bibliotek af farvestofmolekyler syntetiseret med en modulær kemisk tilgang kan føre til forbedret billeddannelse af levende celler. Kredit:A*STAR Institute of Chemical and Engineering Sciences
Molekylært stillads til modificering af fluorescerende forbindelser, der anvendes til biologisk bil…Et bibliotek af farvestofmolekyler syntetiseret med en modulær kemisk tilgang kan føre til forbedret billeddannelse af levende celler. Kredit:A*STAR Institute of Chemical and Engineering Sciences -
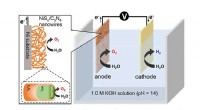 Et skridt nærmere en brintdrevet økonomi ved hjælp af en effektiv anode til vandopdelingSkematisk repræsentation af vanddissociationsprocessen ved lavt overpotentiale på ca. 32 mV ved anvendelse af NiS x nanotråde proppet ind i C 3 N 4 skede som anode til vandoxidation. Kredit:Niig
Et skridt nærmere en brintdrevet økonomi ved hjælp af en effektiv anode til vandopdelingSkematisk repræsentation af vanddissociationsprocessen ved lavt overpotentiale på ca. 32 mV ved anvendelse af NiS x nanotråde proppet ind i C 3 N 4 skede som anode til vandoxidation. Kredit:Niig -
 Iridium og 2-methylphenanthrolin fremskynder katalytiske boryleringsreaktionerProfiler af de Ir-katalyserede reaktioner af THF og dibutylether med B 2 pin 2 med forskelligt substituerede phenanthroliner som ligander. Reaktionerne katalyseres ved kombinationen af 5 mol % [
Iridium og 2-methylphenanthrolin fremskynder katalytiske boryleringsreaktionerProfiler af de Ir-katalyserede reaktioner af THF og dibutylether med B 2 pin 2 med forskelligt substituerede phenanthroliner som ligander. Reaktionerne katalyseres ved kombinationen af 5 mol % [ -
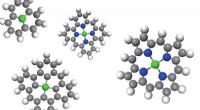 Simpel ligning styrer skabelsen af ren-energi katalysatorerTilpasset fra figur i Nature Catalysis / Springer Nature. Kredit:University of Nebraska-Lincoln Nye retningslinjer fastsat af Nebraska og kinesiske forskere kunne styre designet af billigere, mere
Simpel ligning styrer skabelsen af ren-energi katalysatorerTilpasset fra figur i Nature Catalysis / Springer Nature. Kredit:University of Nebraska-Lincoln Nye retningslinjer fastsat af Nebraska og kinesiske forskere kunne styre designet af billigere, mere
- Brug af arkæologi til at forstå fortiden, til stede, klimaforandringernes fremtid
- Tyfonen Hato efterlader 16 døde efter at have pisket det sydlige Kina
- Bidens nye undersøgelse af mulig Wuhan-lablækage øger skylden mellem USA og Kina
- Hvordan forskere forbedrer vand- og klimaforudsigelsesmodeller i kolde regioner
- At overvinde et batteris fatale fejl
- Hvilke huse overlevede en naturbrand? Tit, dem, der er bygget til at kode


