Findes der hydrogenbindinger i et vandmolekyle?
Hydrogenbindingen i et vandmolekyle har en betydelig indflydelse på dets egenskaber og adfærd. Her er nogle nøgleaspekter relateret til hydrogenbindinger i et vandmolekyle:
1. Polaritet:Tilstedeværelsen af hydrogenbindinger i vand resulterer i dets polaritet. Den delvise positive ladning på brintatomerne og den delvise negative ladning på iltatomet skaber et dipolmoment, hvilket gør vand til et polært molekyle.
2. Kohæsion og overfladespænding:Hydrogenbindinger er ansvarlige for samhørigheden af vandmolekyler. De tiltrækker og holder vandmolekyler sammen, hvilket bidrager til vandets overfladespænding. Overfladespænding muliggør fænomener som vandperler på hydrofobe overflader og dannelse af vanddråber.
3. Højt kogepunkt:Hydrogenbindinger i vandmolekyler resulterer i et højt kogepunkt på 100°C (ved havoverfladen). De stærke intermolekylære kræfter mellem vandmolekyler kræver mere energi at overvinde, hvilket fører til et højere kogepunkt sammenlignet med andre lignende molekyler.
4. Høj specifik varmekapacitet:Vand har en høj specifik varmekapacitet, hvilket betyder, at det kan absorbere eller frigive en betydelig mængde varme uden at gennemgå en stor temperaturændring. Denne egenskab tilskrives den energi, der kræves for at bryde hydrogenbindingerne mellem vandmolekyler.
5. Solvatisering:Hydrogenbindinger i vandmolekyler muliggør opløsning af mange polære stoffer og ioner. De partielle ladninger af vandmolekyler interagerer med ladede partikler eller polære molekyler, omgiver dem og adskiller dem fra hinanden. Denne proces, kendt som solvation, er afgørende for stoffernes opløselighed i vand.
Samlet set bidrager hydrogenbindingerne i et vandmolekyle til dets unikke egenskaber og spiller en afgørende rolle i forskellige biologiske og kemiske processer, herunder dem, der er relateret til जीवन processer og industrielle applikationer.
Sidste artikelHvad er antallet af uparrede elektroner i et lithiumatom?
Næste artikelHvad er massen i g af 0,375 mol element k?
 Varme artikler
Varme artikler
-
 Fentanyl kan gøre first responders syge. Her er en mulig løsningEn dødelig dosis heroin sammenlignet med en dødelig dosis fentanyl. Dette er kun en illustration - stoffet, der faktisk er vist på dette billede, er et kunstigt sødestof. Kredit:© Bruce A. Taylor/NH S
Fentanyl kan gøre first responders syge. Her er en mulig løsningEn dødelig dosis heroin sammenlignet med en dødelig dosis fentanyl. Dette er kun en illustration - stoffet, der faktisk er vist på dette billede, er et kunstigt sødestof. Kredit:© Bruce A. Taylor/NH S -
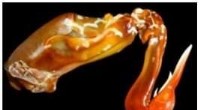 Mantis-rejeklubbens mangefacetterede design er inspirerende avancerede kompositmaterialer til fly, f…Et tværsnit af mantis-rejeklubben viser den stribede region, der var karakteriseret af UCR-forskere. Denne region består af en unik struktur, der vikler sig rundt om køllen for at beskytte den mod sel
Mantis-rejeklubbens mangefacetterede design er inspirerende avancerede kompositmaterialer til fly, f…Et tværsnit af mantis-rejeklubben viser den stribede region, der var karakteriseret af UCR-forskere. Denne region består af en unik struktur, der vikler sig rundt om køllen for at beskytte den mod sel -
 En simpel mekanisme kunne have været afgørende for livets udviklingEt hold ved det tekniske universitet i München (TUM) har for første gang vist, at faseadskillelse er en yderst effektiv måde at styre udvælgelsen af kemiske byggesten på, giver fordele til visse mol
En simpel mekanisme kunne have været afgørende for livets udviklingEt hold ved det tekniske universitet i München (TUM) har for første gang vist, at faseadskillelse er en yderst effektiv måde at styre udvælgelsen af kemiske byggesten på, giver fordele til visse mol -
 Stort dipolmoment induceret bredspektret bismuthchromat for effektiv fotokatalytisk ydeevne(a) sammenligning af fotokatalytisk vandoxidationsaktivitet med forskellige fotokatalysatorer og (b) den bølgelængdeafhængige AQE af vandoxidation over Bi 8 (CrO 4 ) O 11 . (c) sammenligning af
Stort dipolmoment induceret bredspektret bismuthchromat for effektiv fotokatalytisk ydeevne(a) sammenligning af fotokatalytisk vandoxidationsaktivitet med forskellige fotokatalysatorer og (b) den bølgelængdeafhængige AQE af vandoxidation over Bi 8 (CrO 4 ) O 11 . (c) sammenligning af
- Hvordan Body Farms fungerer
- Spændende tegn på faseskiftsturbulens i RHIC-kollisioner
- Svagt 2018 ser Daimler-chef Zetsche forlade på sur note
- Børn med albinisme har svært ved at navigere i skolen. Lærere kan hjælpe.
- Er tamme østers mindre forberedt på klimaændringer?
- Lær om kunstig intelligens:Et knudepunkt for MIT-ressourcer for K-12-studerende


