Kan du ændre kogepunktet for en væske?
1. Tryk: En væskes kogepunkt er direkte proportional med trykket. Det betyder, at når trykket stiger, stiger kogepunktet, og når trykket falder, falder kogepunktet. For eksempel koger vand ved 100 grader Celsius (212 grader Fahrenheit) ved havoverfladen, men det koger ved en lavere temperatur i højere højder, hvor det atmosfæriske tryk er lavere.
2. Urenheder: Tilstedeværelsen af urenheder, såsom opløste salte eller forurenende stoffer, kan øge en væskes kogepunkt. Dette fænomen er kendt som kogepunktsstigning. Forøgelsen af kogepunktet er proportional med koncentrationen af urenheder. For eksempel koger saltvand ved en højere temperatur end rent vand.
3. Opløste gasser: Opløste gasser, såsom luft, kan sænke en væskes kogepunkt. Denne effekt er kendt som kogepunktsdepression. Faldet i kogepunktet er proportionalt med koncentrationen af opløste gasser. For eksempel koger kulsyreholdige drikkevarer, som indeholder opløst kuldioxidgas, ved en lavere temperatur end rent vand.
4. Kemisk sammensætning: Den kemiske sammensætning af en væske bestemmer dens kogepunkt. Væsker med stærkere intermolekylære kræfter, såsom hydrogenbindinger eller dipol-dipol-interaktioner, har højere kogepunkter. For eksempel koger vand, som har stærke brintbindinger, ved en højere temperatur end diethylether, som har svagere van der Waals-kræfter.
Ved at manipulere disse faktorer, såsom at ændre trykket, tilføje urenheder, fjerne opløste gasser eller ændre den kemiske sammensætning, er det muligt at ændre en væskes kogepunkt.
Sidste artikelHvor kommer Octene fra?
Næste artikelHvad er 3 forskellige måder, du kan klassificere blandinger på?
 Varme artikler
Varme artikler
-
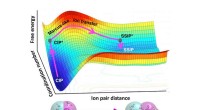 Elegant teori viser, hvordan vand hjælper med at adskille ioner involveret i materialesyntese og -f…Adskillelsen (bunden) af lithiumfluorid (Li og F) ionpar involverer to trin:(1) en forøgelse af vandkoordinationen omkring ionerne (kontaktionpar, CIP til CIP*) og (2) rumlig adskillelse af ionerne (C
Elegant teori viser, hvordan vand hjælper med at adskille ioner involveret i materialesyntese og -f…Adskillelsen (bunden) af lithiumfluorid (Li og F) ionpar involverer to trin:(1) en forøgelse af vandkoordinationen omkring ionerne (kontaktionpar, CIP til CIP*) og (2) rumlig adskillelse af ionerne (C -
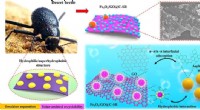 Ørkenbille-inspireret magnetisk demulgator udviklet med fremragende olie-i-vand emulsionsseparation…Grafisk abstrakt. Kredit:DOI:10.1016/j.cej.2021.130904 Prof. Zeng Zhixiangs team ved Ningbo Institute of Materials Technology and Engineering (NIMTE) under det kinesiske videnskabsakademi (CAS) ud
Ørkenbille-inspireret magnetisk demulgator udviklet med fremragende olie-i-vand emulsionsseparation…Grafisk abstrakt. Kredit:DOI:10.1016/j.cej.2021.130904 Prof. Zeng Zhixiangs team ved Ningbo Institute of Materials Technology and Engineering (NIMTE) under det kinesiske videnskabsakademi (CAS) ud -
 Forskere laver næste generation, batterikomponent med høj sejhedForskning viser, at grafen (rGO) kan hjælpe med at forhindre spredning af revner i keramiske materialer, der bruges til batterielektrolytter. Kredit:Brown University Et hold af Brown University-fo
Forskere laver næste generation, batterikomponent med høj sejhedForskning viser, at grafen (rGO) kan hjælpe med at forhindre spredning af revner i keramiske materialer, der bruges til batterielektrolytter. Kredit:Brown University Et hold af Brown University-fo -
 Molekylære porer kunne forbedre effektiviteten af olieraffinering og farmaceutisk fremstillingKAUST -forskere har udviklet en ultratynd membran, der kan gøre organisk opløsningsmiddelseparation mere bæredygtig og grønnere. Kredit:KAUST; Ivan Gromicho Skive-tynde membraner, der er skrædders
Molekylære porer kunne forbedre effektiviteten af olieraffinering og farmaceutisk fremstillingKAUST -forskere har udviklet en ultratynd membran, der kan gøre organisk opløsningsmiddelseparation mere bæredygtig og grønnere. Kredit:KAUST; Ivan Gromicho Skive-tynde membraner, der er skrædders
- Træprodukter afbøder mindre end 1 % af de globale kulstofemissioner
- Udkast til FN -rapport advarer om stigende hav, stormfloder, smeltende permafrost
- Hvordan afrikanske feminister hjælper med at opretholde fred i en pandemi
- Tweeting -raseri:Hvordan immigrationspolitikker kan polarisere den offentlige diskurs
- Hvis du brugte saltsyre og metal, ville reaktionen have været den samme, hvis du havde svovl?
- Ny matematisk model hjælper med at forklare Rogue Waves


