Hvorfor skulle kogepunktet for en opløsning være højere end det rene opløsningsmiddel?
Hvor meget kogepunktet er forhøjet afhænger af opløsningens koncentration. Jo mere koncentreret opløsningen er, jo højere er kogepunktet. Dette skyldes, at der er flere opløste partikler til stede for at forstyrre de intermolekylære kræfter mellem opløsningsmiddelmolekylerne.
En opløsnings kogepunktsstigning er en kolligativ egenskab, hvilket betyder, at den kun afhænger af opløsningens koncentration og ikke af identiteten af de opløste partikler. Dette står i modsætning til egenskaber som kogepunkt og frysepunkt, som påvirkes af både koncentrationen og identiteten af de opløste partikler.
 Varme artikler
Varme artikler
-
 Belysning af stien for cellerNeuroner følger det kortlagte mønster i en hydrogel. Kredit:ETH Zürich ETH -forskere har udviklet en ny metode, hvor de bruger lys til at tegne mønstre af molekyler, der styrer levende celler. Fre
Belysning af stien for cellerNeuroner følger det kortlagte mønster i en hydrogel. Kredit:ETH Zürich ETH -forskere har udviklet en ny metode, hvor de bruger lys til at tegne mønstre af molekyler, der styrer levende celler. Fre -
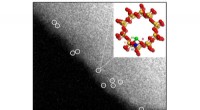 En måde at omdanne metan direkte til methanol eller eddikesyre under milde forholdAberrationskorrigerede HAADF/STEM-billeder af asyntetiseret Rh-ZSM-5. Enkelt rhodiumkationer er omkranset i hvidt med foreslået bold-stick-model af strukturen. Kredit:Lawrence F. Allard, medforfatter
En måde at omdanne metan direkte til methanol eller eddikesyre under milde forholdAberrationskorrigerede HAADF/STEM-billeder af asyntetiseret Rh-ZSM-5. Enkelt rhodiumkationer er omkranset i hvidt med foreslået bold-stick-model af strukturen. Kredit:Lawrence F. Allard, medforfatter -
 Native New Zealand-træ sætter brodden på smerteKredit:Institute for Molecular Bioscience, University of Queensland Forskere ved University of Queensland (UQ) har fundet ud af, at et indfødt newzealandsk stikkende træ producerer toksiner, der ka
Native New Zealand-træ sætter brodden på smerteKredit:Institute for Molecular Bioscience, University of Queensland Forskere ved University of Queensland (UQ) har fundet ud af, at et indfødt newzealandsk stikkende træ producerer toksiner, der ka -
 Et fast opløsningsmiddel til unikke materialerSyntese af nyt materiale ved hjælp af et fast opløsningsmiddel. Et substrat dækket med et system af ensartet fordelte ankre nedsænkes i en opløsning indeholdende de ønskede atomer eller molekyler, som
Et fast opløsningsmiddel til unikke materialerSyntese af nyt materiale ved hjælp af et fast opløsningsmiddel. Et substrat dækket med et system af ensartet fordelte ankre nedsænkes i en opløsning indeholdende de ønskede atomer eller molekyler, som
- Storstilet råvaredyrkning fremskynder klimaændringer i Amazonas
- Team skaber en strømgenerator, der kører på naturlig atmosfærisk luftfugtighed
- Er snyd på banen værre end en ægtefælle? Det mener nogle fans
- Husstande, hvor kvinden er eneforsørger, er væsentligt fattigere, siger forskning
- Planternes kraft og hvordan de ændrer måden, vi spiser på, lever
- Hvad ville der ske, hvis en celle ikke havde ribosomer?


