Hvorfor kan varmt vand opløses hurtigere end koldt vand?
Varmt vand har en lavere overfladespænding end koldt vand. Overfladespænding er den kraft, der holder vandmolekyler sammen ved vandoverfladen. Når vandet opvarmes, falder overfladespændingen. Dette gør, at vandmolekylerne lettere kan spredes ud, hvilket er med til at øge opløsningshastigheden.
Varmt vand kan indeholde flere opløste faste stoffer end koldt vand. Når temperaturen af vand stiger, stiger opløseligheden af de fleste faste stoffer også. Det betyder, at varmt vand kan indeholde flere opløste faste stoffer end koldt vand. Dette skyldes, at vandmolekylernes øgede kinetiske energi er med til at nedbryde de opløste partikler og holde dem svævende i vandet.
Her er nogle eksempler på, hvordan varmt vand opløses hurtigere end koldt vand:
- Sukker: Sukker opløses hurtigere i varmt vand end i koldt vand. Det skyldes, at varmtvandsmolekylerne nedbryder sukkerkrystallerne hurtigere, så de opløses hurtigere.
- Salt: Salt opløses hurtigere i varmt vand end i koldt vand. Dette skyldes, at varmtvandsmolekylerne nedbryder saltkrystallerne hurtigere, så de opløses hurtigere.
- Sæbe: Sæbe opløses hurtigere i varmt vand end i koldt vand. Det skyldes, at varmtvandsmolekylerne nedbryder sæbemolekylerne hurtigere, så de opløses hurtigere.
Generelt kan varmt vand opløse stoffer hurtigere end koldt vand. Det skyldes, at det varme vands højere temperatur øger vandmolekylernes kinetiske energi, hvilket er med til at nedbryde de opløste partikler og holde dem svævende i vandet.
 Varme artikler
Varme artikler
-
 Nøglen til at sænke kuldioxidemissionerne er lavet af metalDe tilsyneladende rater for det ME-katalyserede malat (v0) under tilstanden NADPH, pyruvat, natriumbicarbonat og ME indeholdende aluminiumioner (røde). Kredit:Yutaka Amao, Osaka City University Ku
Nøglen til at sænke kuldioxidemissionerne er lavet af metalDe tilsyneladende rater for det ME-katalyserede malat (v0) under tilstanden NADPH, pyruvat, natriumbicarbonat og ME indeholdende aluminiumioner (røde). Kredit:Yutaka Amao, Osaka City University Ku -
 Forskere låser op for kræftfremkaldende mekanisme af E. coli-toksin med syntetisk biologi tilgangProf. Qian Peiyuan (til højre) og en forsker fra hans team, LI Zhongrui, dyrkning af bakterier med maskinen til højre. Kredit:Hong Kong University of Science and Technology Et tværfagligt team af
Forskere låser op for kræftfremkaldende mekanisme af E. coli-toksin med syntetisk biologi tilgangProf. Qian Peiyuan (til højre) og en forsker fra hans team, LI Zhongrui, dyrkning af bakterier med maskinen til højre. Kredit:Hong Kong University of Science and Technology Et tværfagligt team af -
 Ny teknik kan strømline lægemiddeldesignKredit:CC0 Public Domain Forskere har udviklet en proces, der kraftigt kan reducere arbejdet involveret i computerproteindesign, ifølge en undersøgelse i Proceedings of the National Academy of Sc
Ny teknik kan strømline lægemiddeldesignKredit:CC0 Public Domain Forskere har udviklet en proces, der kraftigt kan reducere arbejdet involveret i computerproteindesign, ifølge en undersøgelse i Proceedings of the National Academy of Sc -
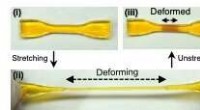 Selvvoksende materialer, der styrker som reaktion på kraftEn dobbeltnetværkshydrogel (i). Efter strækning (ii), skøre sektioner går i stykker, tillader en generation af mekanoradikale stoffer, angivet ved farveændring (iii). Kredit:Gong J.P. et al., Mekanore
Selvvoksende materialer, der styrker som reaktion på kraftEn dobbeltnetværkshydrogel (i). Efter strækning (ii), skøre sektioner går i stykker, tillader en generation af mekanoradikale stoffer, angivet ved farveændring (iii). Kredit:Gong J.P. et al., Mekanore
- Hvordan folk taler nu har spor om menneskelig migration for århundreder siden
- Hvordan voldtægtsmyter, ubevidste skævheder skader retssystemet mod kvinder og især overlevende
- Når naturkatastrofen rammer, mænd og kvinder reagerer forskelligt
- Hvorfor bør børn lære at opbygge en positiv online tilstedeværelse
- Hvad den seneste vurdering af global opvarmning betyder for det sydlige Afrika
- Hvad er tungere et atom af palladium eller kviksølv?


